
锂金属电池(LMBs)因其超高的能量密度(超过400 Wh/kg)而被视为下一代能源存储技术的有力候选。然而,锂金属负极的高活性(-3.041 V vs. 标准氢电极)导致电解液的持续还原反应,从而引发低库仑效率、锂枝晶不可控生长以及安全隐患,尤其是在极端温度条件下。尽管已有多种策略用于改善电解液的热稳定性和安全性,但在宽温度范围内实现稳定的锂金属电池仍面临巨大挑战。
【工作简介】
近日,哈尔滨工业大学马玉林、付传凯团队提出了一种由磷酸三乙酯(TEP)、双(三氟甲基磺酰基)酰亚胺锂(LiTFSI)和硝酸锂(LiNO3)组成的全气候阻燃电解液。NO3-与TEP之间的强相互作用将电解液的熔点拓宽至-91.5℃。优化的锂离子溶剂化结构具有低去溶剂化能,有助于形成耐用的无机-有机混合固体电解质界面(SEI)和正极电解质界面(CEI),显著提高了界面兼容性。因此,采用优化的TEP基电解液的锂金属电池(LMBs)在-60∼100℃的宽温度范围内展现出卓越的电化学性能。这项工作获得的见解为开发宽温电解液和高性能LMBs提供了理论指导。该成果发表在“ACS Energy Letters”期刊,第一作者是马驰、付传凯。
【内容表述】
为了实现宽温域电池体系,电解液尤为关键。电解液在低温下的地电导率和缓慢的传输动力学是造成电池极化和枝晶生长的主要原因。此外,较高温度下界面的不稳定性导致连续的电解液分解和固体电解质界面(SEI)的形成,并产生气体。本文设计的电解体系为(1 M LiTFSI + 0.5M LiNO3 in TEP)。电解液中硝酸锂(LiNO3)的加入使得NO3-阴离子与三乙基磷酸酯(TEP)溶剂分子之间形成强相互作用。这种相互作用破坏了溶剂分子的规则排列,增加了分子的无序性,从而显著降低了电解液的熔点,使其在-91.5℃时仍保持液态,拓宽了电解液的工作温度范围。NO3-的引入改变了锂离子(Li+)的溶剂化结构,从传统的溶剂主导型转变为阴离子主导型。阴离子主导的溶剂化结构促进了富含无机成分(如LiF、Li3N和Li2S)的SEI膜在锂金属负极表面的形成,同时在正极表面形成了稳定的CEI膜。这些界面膜具有优异的离子导电性和热稳定性,能够有效抑制溶剂分子与锂金属的副反应,减少界面膜的溶解和重建,从而显著提高了电池在高温和低温条件下的循环稳定性和安全性。
如图1a所示,由于溶剂主导的溶剂化结构的高结合能,Li+在传统TEP基电解质中的去溶剂化很困难。这导致锂离子在电极/电解质界面中的动力学缓慢,从而显著降低了电池的低温性能。同时,在溶剂主导的溶剂化结构的电解质体系中,容易产生富含有机成分的界面膜(阴极/电解质界面和阳极/电解质界面)。在高温条件下这些界面膜在循环过程中经历连续的击穿和重建,导致电解质耗尽和电池故障。为了解决上述问题,我们采用阴离子-溶剂相互作用策略来调节溶剂化结构并降低电解质体系的熔点。如图1b所示,由于NO3-阴离子和TEP溶剂分子之间的强相互作用力,可以自发形成“结合”结构。特殊的“结合”结构可以打破溶剂分子的规则排列结构,增加溶剂分子的无序性,降低电解质体系的熔点,显著提高电池的低温性能。此外,NO3-阴离子可以进入溶剂化结构,这有利于降低脱溶剂能,构建高温稳定的界面膜。
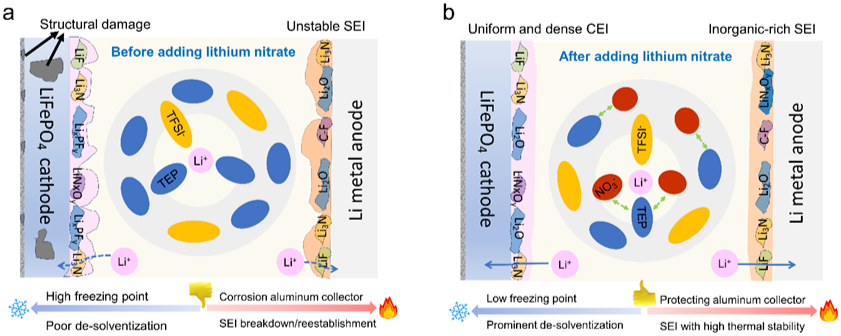
图1. 宽温电解液设计策略示意图。溶剂化结构及电极/电解液界面条件如下:(a)无 LiNO3;(b)有 LiNO3。
在我们的工作中,TEP被用作唯一的溶剂,LiTFSI(1.0M)完全溶解在TEP溶剂中,并向溶剂中加入不同浓度的LiNO3(0M、0.25M、0.5M、1.0M),分别表示为E0、E0.25、E0.5和E1.0。如图2a所示,LiNO3具有较高的HOMO值和较低的LUMO值。此外,如图2b的上部所示,由于TEP和NO3-之间的强亲和力,电子离域导致NO3-周围的负电荷趋于平均。同时,如图2b下部所示,NO3-阴离子的N-O键到TEP分子的C-H键的平均距离小于2.5Å,这表明NO3-和TEP之间的范德华相互作用很强。如图2c所示,溶剂化TFSI-峰和溶剂化TEP峰表明TFSI-和NO3-参与了Li+溶剂化结构。核磁测试结果同样表明了这一点。进行分子动力学(MD)模拟以说明Li+溶剂化结构。整个溶液系统的代表性离子聚集体表明,NO3-已成功进入溶剂化结构并靠近TEP分子(图2d-e、g-h)。此外,脱溶剂能的计算结果表明,添加NO3-会将去溶剂化能降低到9.38 eV。同时,Li+的溶剂化结构随着NO3-的加入而发生显著变化。具体而言,E0.5电解质中的NO3-配位数达到1.037,而TEP配位数从2.576降低到1.937,表明从溶剂主导的溶剂化结构转变为阴离子主导的溶剂结构(图2f,i)。这表明,当温度升高时,阴离子更容易进入溶剂化结构,但当温度下降时,溶剂更容易进入溶液化结构。上述DFT计算和MD模拟结果与实验结果高度一致,从理论层面验证了电解质设计的合理性。
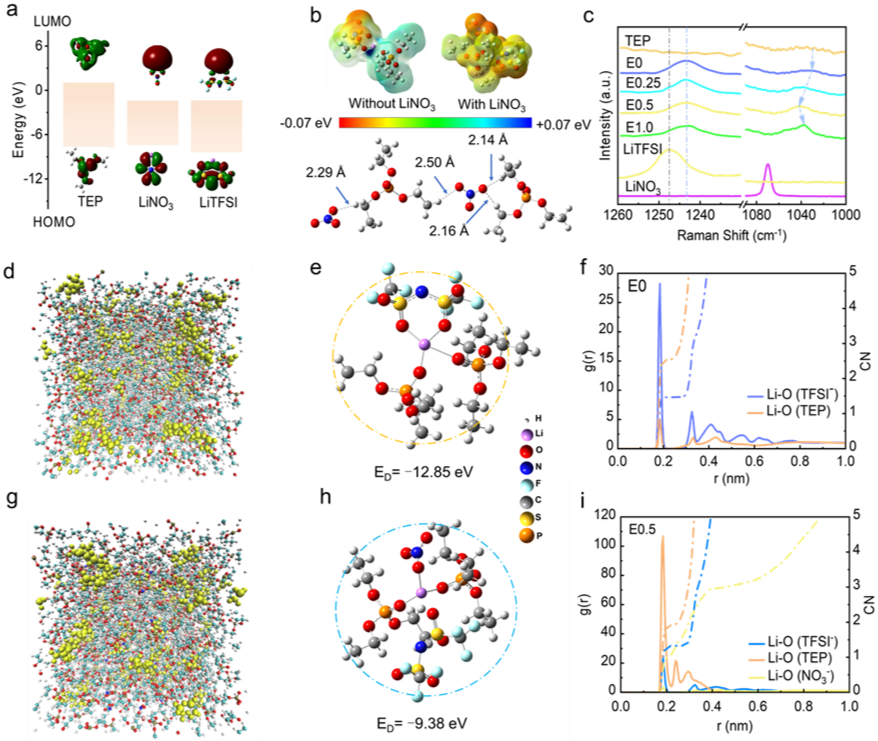
图2. 不同电解液中溶剂化结构的理论与实验分析。(a)溶剂分子及各种电解液的HOMO/LUMO能级;(b)溶剂分子的静电势分布以及NO3-与 TEP分子之间的键长;(c)溶剂、锂盐及各种电解液的拉曼图谱;(d−f) E0电解液的分子动力学(MD)模拟结果:(d) E0 电解液的模拟盒快照;(e)25℃下 MD 模拟的代表性离子聚集体,底部显示去溶剂化能。颜色方案:Li,紫色;N,蓝色;F,青色;S,黄色;C,灰色;P,棕色;O,红色;H,白色。(f)E0 电解液RDF和CN;(g−i) E0.5电解液的 MD 模拟结果:(g)E0.5电解液的模拟盒快照;(h)25℃下 MD 模拟的代表性离子聚集体,底部显示去溶剂化能;(i) E0.5 电解液的 RDF 和 CN。
这种独特的溶剂化结构也对新型电解质体系的物理化学性质产生了重大影响。首先,引入LiNO3可以显著抑制TEP溶剂和Li金属之间的不良副反应。其次,含有LiNO3的电解质对商用隔膜具有更高的润湿性。除了上述优点外,如图3a和图3b中的DSC曲线所示,宽温度电解质系统还表现出超宽的液体范围。值得注意的是,E0.5电解质的熔点为-91.5℃,明显低于BE的熔点(-51.7℃)。熔点的降低应归因于LiNO3的引入。NO3-和TEP分子之间强烈的阴离子-溶剂相互作用不仅破坏了TEP分子的规则排列,还增加了电解质的无序性,从而降低了电解质的熔点。此外,如图3c所示,E0.5的热分解温度超过110℃,优于BE(低于50℃)。增强的热稳定性有利于电池的安全性。同时,改性的TEP基电解质体系保持了优异的阻燃性(图3d)。在明火加热条件下,TEP基电解质的自熄时间小于0.5秒(图3e)。相比之下,易燃的商用电解质会经历强烈的燃烧。此外,锂金属袋电池的安全测试结果表明,即使在火焰和剪切的恶劣条件下,它们也能保持高水平的安全性。即使在-60℃(超过2×10-4 S cm-1)下的离子电导率仍然优于大多数碳酸盐基液体电解质。此外,E0.25、E0.5和E1.0的tLi+分别为0.54、0.64和0.46,高于E0(0.11),有利于实现高倍率能力。同时,添加硝酸锂(E0.5)后,阻抗显著降低,这可能是由于界面稳定性的提高。所有电解质在室温下的氧化电压均超过4.5V,这表明那些用LiNO3辅助的电解质仍然可以满足配备高压阴极材料(如LiCoO2和LiNixCoyMn1-x-yO2)的高比能LMB的要求。
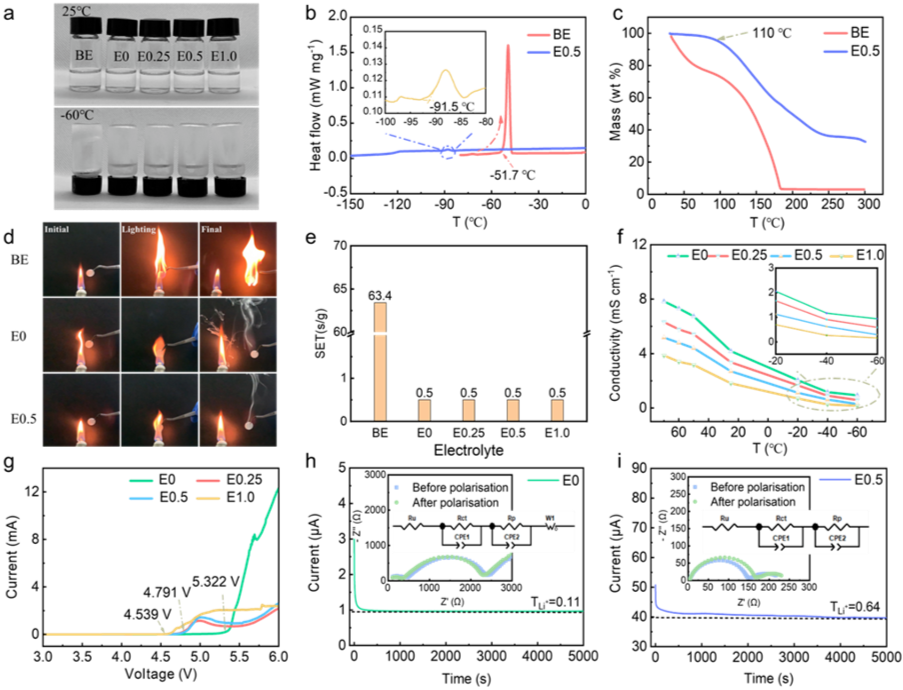
图3. 宽温电解液的物理性质。(a)不同电解液在25℃和-60℃下存放30分钟后的数码照片;(b)商业电解液(1M LiPF6 EC/DEC 1:1 v:v,以下简称 BE)和E0.5电解液的差示扫描量热(DSC)曲线;(c) BE和E0.5电解液的热重分析曲线;(d)阻燃性测试;(e)自熄时间测试;(f)离子电导率随温度的变化;(g)Li||Al 电池的线性扫描伏安(LSV)曲线,用于氧化稳定性测试(0.5 mV s-1,3−6 V);(h)E0和(i)E0.5在25℃下的锂离子迁移数(插图显示极化前后的电池Nyquist阻抗谱)。
对Li-Cu不对称电池和Li-Li对称电池进行了研究,以评估不同电解质与Li阳极的相容性。研究发现,Li||Cu电池中含有LiNO3的电解质可以稳定运行200多次循环,具有较高的平均库仑效率(CE,~94%),而E0电解质的CE较差,在几次循环后就会失效(图4a)。此外,E0系统中沉积在铜箔上的Li金属的成核过电位和生长过电位分别为113.7 mV和93.9 mV,高于含LiNO3电解质系统的电池(图4b)。值得注意的是,采用E0.5电解质的Li||Cu电池显示出最低的成核电位(70.6 mV)和生长过电位(43.7 mV),初步证明了含LiNO3电解质在提高锂利用效率和稳定锂阳极界面方面的优越性。图4c显示E0对称电池的极化电位在20个周期内从60.5 mV迅速增加到200 mV以上。相比之下,具有含LiNO3电解质系统的对称电池可以在稳定和较低的极化电位下运行400小时以上。特别是,如图4d-f所示,E0.5的对称电池的极化电位约为31.6 mV,低于E0.25(47 mV)和E1.0(64 mV)的电池。这些结果表明,适当浓度的硝酸锂可以在宽温度范围内提高TEP和锂金属之间的相容性,并增强低温下的去溶剂化能力。LiNO3在提高锂可逆性方面的可能作用机制如图4g,h所示。
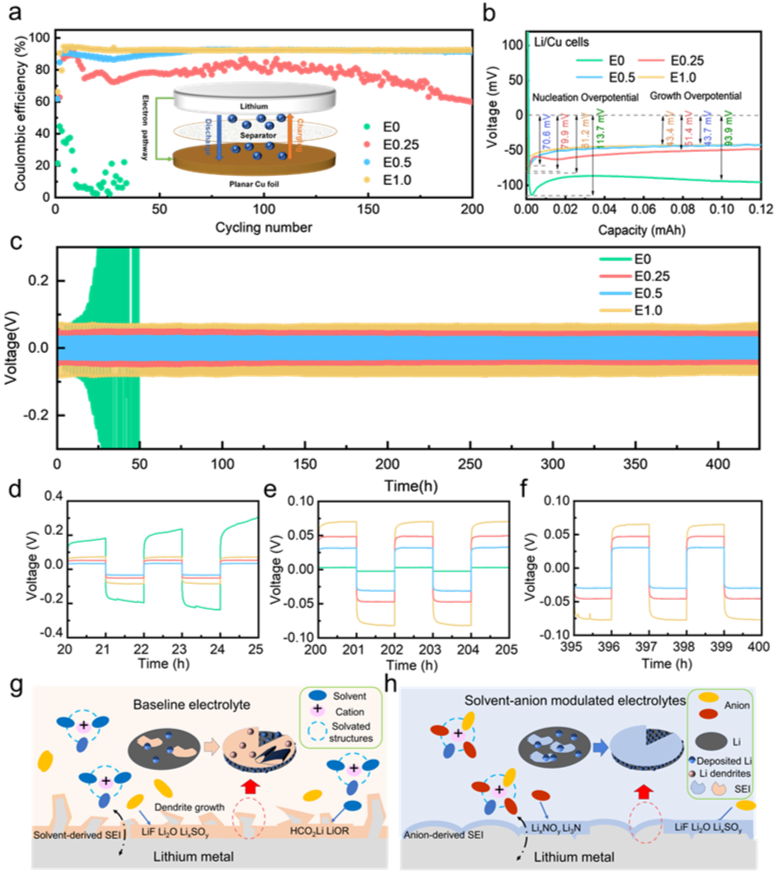
图4. 对称电池的电化学性能。(a)Li||Cu不对称电池的库仑效率;(b)Li||Cu不对称电池的电容-电压曲线放大图;(c)Li||Li对称电池的恒流循环性能,电流密度为 0.25 mA cm-2;(d−f)Li||Li对称电池的电压-时间放大图;(g)基础电解液对锂金属可逆性的影响;(h)阴离子-溶剂调节电解液对锂金属可逆性的影响。
为了进一步验证含LiNO3电解质的优越性,对具有LiFePO4(LFP)阴极电池的LMBs的电化学性能进行了研究。如图5a所示,E0的全电池在1C的倍率下表现出较差的循环性能,放电比容量在前30个循环中迅速下降,平均CE低至94%。相反,在相同条件下,含LiNO3电解质系统的全电池可以稳定循环300多次。如图5b所示,E0、E0.25和E0.5的全电池在低工作速率(0.1C、0.2C和0.5C)下显示出类似的放电容量。值得注意的是,E0.5的全电池显示出最佳的倍率性能,在10C的高倍率下保持约50%的容量。为了分析全电池在循环过程中的界面稳定性,图5c、d记录并显示了50次循环前后各种电解质全电池的界面阻抗演变。与采用E0和E1.0的电池相比,采用E0.25和E0.5的电池表现出相当稳定的界面阻抗,这与循环性能非常一致。此外,在50次循环后,与对称电池相比,Li||LFP全电池显示出显著的减少,这表明阴极与电解质系统的界面相容性比锂阳极相对更高。根据研究结果,阳极界面的失效可能是电池性能下降的主要原因。此外,如图5f、g所示,E0.5的全电池在-20℃下可以实现148 mAh g–1的高放电比容量,在-30℃下可以达到118 mAh g-1的高放电容量,分别相当于常温容量的96.0%和76.0%。在0.1C的电流密度下循环50次后,全电池的容量保持率分别为99.5%和99.14%。值得注意的是,即使在-40℃和-60℃的极低温度下,E0.5的全电池仍然可以分别提供99 mAh g–1和50 mAh g-1的良好放电容量(图5h)。相比之下,具有E0的全电池在低温条件下会迅速失效。此外,在50℃和1C下循环100次后,使用E0.5电解质的电池的容量保持率高达97.3%。令人惊讶的是,E0.5的全电池可以在75℃和100℃下稳定循环,并在50次循环后分别保持86.7%和80.2%的高容量保留率(图5j)。相比之下,E0全电池的可逆容量在10个循环内降至零。如图5e和图S19所示,所有电池的总阻抗随着温度的升高而增加,这表明温度对电池的界面性能有很大影响。E0.5电解质电池的阻抗对温度的敏感性最低,表明E0.5与两个电极具有最佳的界面相容性。优异的高温电化学性能应归功于强烈的阴离子-溶剂相互作用,这种相互作用允许额外的阴离子进入溶剂化结构,并驱动形成具有优异离子导电性的富含无机物的CEI和SEI薄膜。与宽温电解质领域的先前报告相比,我们的研究在可用温度范围方面处于更先进的地位(图5k)。
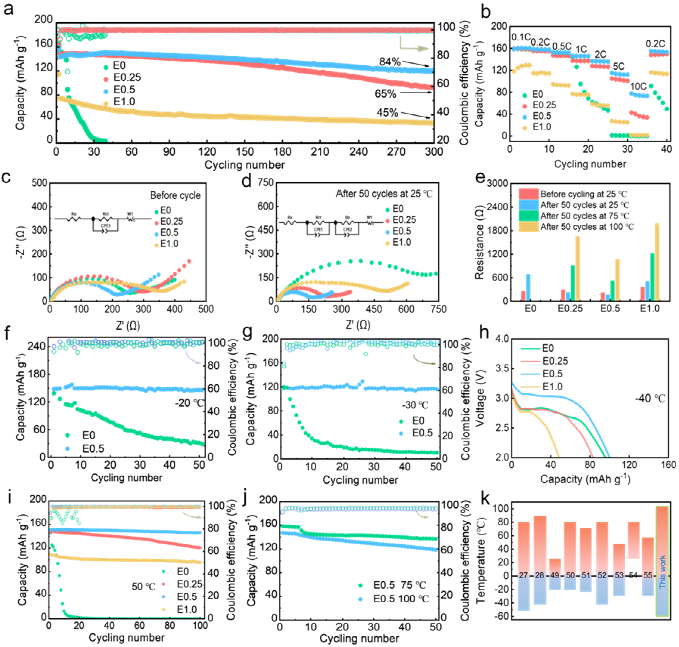
图5. Li||LF 电池在宽温范围内的电化学性能。(a)室温下1C的循环性能;(b)室温下0.1C-10C的倍率性能;(c)室温下循环前的Nyquist图;(d)室温下50次循环后的Nyquist图;(e)不同温度下循环前后阻抗变化总结;(f)-20℃和0.1C下的循环性能;(g)-30℃和0.1C下的循环性能;(h)-40℃和0.1C下的放电性能;(i)50℃和1C下的循环性能;(j)75℃和100℃下1C的循环性能;(k)文献总结与对比。
使用原位拉曼光谱研究了充放电过程中的界面Li+配位,以更多地研究Li+在实际条件下的溶剂化结构。如图6b和6c所示,随着电压的变化(图6a),与E0电解质相比,E0.5电解质中Li-TEP的结合峰发生了显著变化。这表明,在添加LiNO3后,介电状态对Li+的溶剂化结构有更强的影响。此外,如颜色深度所示,E0.5电解质的游离TEP量显著下降。因此,界面的稳定性得到了提高。此外,在充电和放电过程中进行了准原位EIS测试。如图6d和f所示,与循环后电池的阻抗相似,E0.5电解质的阻抗较低。DRT方法用于准确分析不同时间尺度下的电极动力学。一般来说,τ值越小,电化学动力学越快。如图6e所示,E0电解液的τ随着电压的变化而增加,而E0.5电解液的τ保持不变。这表明添加硝酸锂提高了SEI的稳定性,增强了离子传输能力。通过结合原位拉曼光谱和准原位EIS的结果,硝酸锂通过阴离子-溶剂相互作用减少游离TEP分子并增加溶剂化结构中阴离子的比例,从而提高了界面稳定性和离子传输能力。
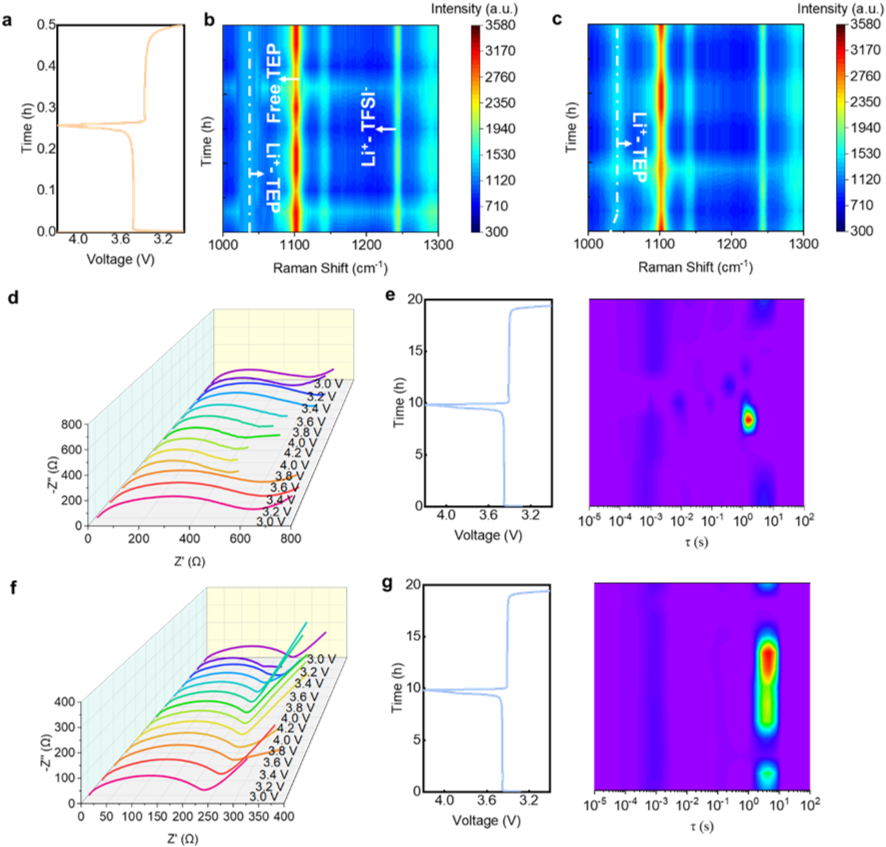
图6. (a)Li||LFP电池的对应时间-电压图;在(b)E0和(c)E0.5电解液中锂充放电过程的原位拉曼图谱变化;(d)E0和(f)E0.5电解液的电池充放电过程阻抗变化;(e)E0和(g)E0.5电解液的对应DRT结果。
在各种电解质系统中进行50次循环后,对Li阳极和LFP阴极进行了异位SEM测试。如图7a所示,在E0和E1.0循环后,锂阳极上可以观察到苔藓状的锂树枝状晶体,在E0.25循环后的锂阳极显示出可见的裂缝。相反,在E0.5循环后,锂阳极表现出致密、光滑和无枝晶的状态。对于LFP阴极(图7b),在E0中循环后,电极裂纹和表面被副反应产物覆盖。值得注意的是,在含LiNO3的电解液中循环后,阴极的形态保持良好,特别是对于E0.5。电极形态的对比与循环性能非常一致。为了进一步探索循环后电极表面形成的CEI和SEI的组成,进行了XPS测试。图7c显示了锂阳极的XPS光谱。在C 1s光谱中,E0中C-O和C=O键的含量最高,表明溶剂分解更多。根据早期的研究,人们寻求LiNxOy、Li3N和LiF等无机物质来提高固态电解质膜的离子电导率和结构稳定性。在E0.5电解液中循环后,发现LiNxOy、Li3N和LiF等无机物质的比例最高。此外,在E0.5中循环后,源自TFSI的CF3峰的出现表明SEI较薄,形成的副产物较少。因此,在E0.5电解质中,所得SEI表现出最高的稳定性,锂沉积更致密、更均匀。锂阳极的蚀刻XPS光谱表明,在E0.5电解质中形成的CEI呈现出最大的无机物种比和适度的有机成分,这表明有机-无机复合SEI是由E0.5电解质形成的。此外,随着蚀刻深度的增加,无机材料的比例保持不变,证实了SEI的精细和稳定。相比之下,E0和E1.0电解质的无机物含量相对较低。随着蚀刻深度的增加,无机成分的比例进一步下降,表明相关的SEI相对松散和易碎。对于循环LFP阴极的XPS光谱(图7d),在添加LiNO3后的C 1s光谱中,源自PVDF的CF2CH2峰的出现以及C-O和C=O峰比率的降低表明CEI中表面副产物的含量降低。此外,无机化合物如LiNxOy和Li3N的含量随着硝酸锂浓度的增加而增加,表明LiNO3参与了CEI的形成。然而,在30 nm的蚀刻后,E1.0电解质产生的SEI和CEI中仍然可以检测到NO3-(图S22),这意味着NO3-在电极表面以LiNO3的形式沉淀,阻碍其他物质的分解,降低LiF和C-F的氟化物含量。极化电位增加、CEI稳定性降低和锂离子沉积受阻等其他问题进一步导致性能下降。总的来说,锂阳极和LFP阴极的XPS光谱分析结果与上述循环性能完全一致。
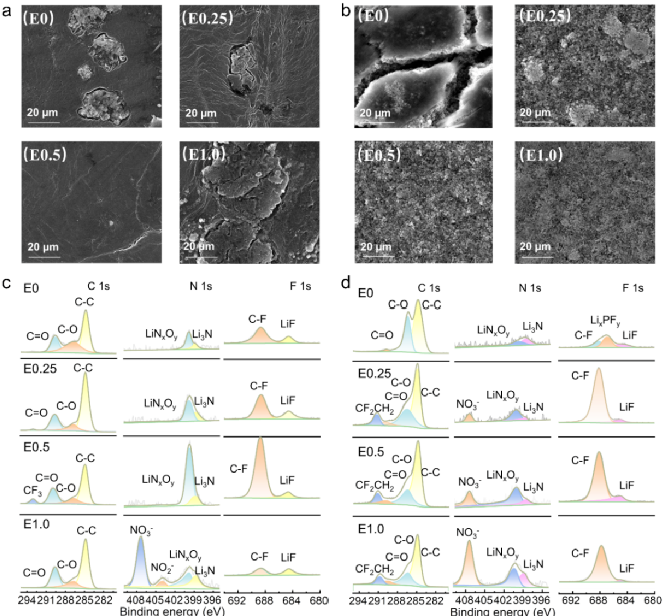
图7. Li||LFP电池的界面特性。(a)在E0、E0.25、E0.5和E1.0中循环50次后的锂负极SEM图像;(b)在E0、E0.25、E0.5和E1.0中循环50次后的LFP正极SEM图像;(c, d)循环50次后的Li||LFP电池的XPS结果。(c)使用不同电解液的锂负极的C、N和F XPS谱(从左到右);(d) 使用不同电解液的 LFP正极的C、N和F XPS谱(从左到右)。
核心结论
通过利用NO3-与TEP分子之间的强阴离子-溶剂相互作用,显著改变了锂离子的溶剂化结构,形成了以阴离子为主的溶剂化结构,并构建了富含无机成分的稳定SEI膜。与基础电解液相比,E0.5 电解液的液态温度范围(-91.5℃ 至 100℃)显著拓宽,同时解决了磷酸酯与锂负极的兼容性问题。在E0.5电解液中,Li||Li对称电池能够在低至31.6mV 的极化电压下稳定循环超过400小时。此外,该电解液在100℃下50个循环后仍能保持80.2%的容量,在-20℃和-30℃的低温下分别保持室温放电容量的96%和76.0%。最为显著的是,即使在-40℃和-60℃的极端低温下,该电解液仍能提供99mAh g-1和50 mAh g-1的比容量。本研究挑战了磷酸酯仅能作为高温阻燃剂的传统观念,揭示了阴离子-溶剂相互作用对电极/电解液界面、溶剂化结构和熔点的影响,并为宽温电解液的设计提供了新思路。
来源:能源学人
【文献详情】
Ma, C., Fu, C., Chang, S., Xu, X., Zhang, G., Liu, Z., Huo, H., Fan, L., Yin, G., & Ma, Y. All-climate and nonflammable electrolyte with a strong anion–solvent interaction for high-performance lithium metal batteries. ACS Energy Letters, 10(3), 1700–1711.
https://doi.org/10.1021/acsenergylett.4c03307
锂电联盟会长向各大团队诚心约稿,课题组最新成果、方向总结、推广等皆可投稿,请联系:邮箱libatteryalliance@163.com或微信Ydnxke。