受到人体内纤毛驱除外来物质的机制启发,该研究通过声辐射力实现了对液体浸没材料表面上黏附细菌的定向清除,为功能抗菌表面与开放环境下主动抗污表面的设计提供了全新的思路。

在自然界中,细菌可以分泌多糖等粘性物质,通过界面作用粘附在材料表面。当微生物不可逆地粘附在浸没于液体环境中的材料表面上并产生促进粘附且提供结构基质的细胞外聚合物时,就会形成微生物生物膜。材料表面上形成的生物膜会引起病原菌的传播和微生物污染。这将给食品包装、医用织物、生物传感器、生物医疗设备带来细菌感染风险。生物膜相关感染很难治疗,因为生物膜细胞对抗菌药物的耐受性极高(与浮游细菌相比高出1000倍),严重危害着人类的健康。
一些研究表明,防止细菌和微生物危害的一种可行的科学方法是开发各种细菌抗粘附表面,以防止细菌的初始粘附和细菌生物膜的形成。目前,常见的细菌抗粘附表面可以分为依靠改变表面的特性进而抑制细菌粘附的被动表面,以及依靠外部能量干预的主动表面。然而,在浸没于液体的表面上实现细菌定向清除仍然具有挑战性。如果无法及时的从表面清除细菌,细菌就会在表面堆积和回流。如果仅仅只是杀死细菌,就会导致细菌中的内毒素和有毒金属元素释放在环境中,造成环境的污染。因此,理想的抗菌表面是定向清除而不杀死细菌,从而防止细菌在材料表面上堆积和污染。
受到大自然的启发,一种典型的细菌定向清除系统是位于人体肺部上皮细胞上的纤毛层,可以有效排出由呼吸道进入人体的细菌和有害物质。纤毛的定向运输物体的机制,主要依靠两个方面:首先,位于纤毛层上方的黏液层由形成凝胶的大分子(如糖蛋白和多糖)组成,因此黏液层具有捕获细菌和有害物质的能力。然后,纤毛的异步运动驱动黏液层带着被捕获的细菌和有害物质定向排出体外。纤毛的定向除菌机制,为我们提供了一种理想的抗菌策略。目前已经有不同的仿生纤毛驱动技术,例如磁场、光学、电场、电化学等。然而,由于现存的驱动源的限制,导致在细菌尺度(纳米到微米)的定向运输仍然难以实现。
据麦姆斯咨询报道,近日,大连理工大学机械工程学院张磊副教授/孙吉宁教授研究团队利用正电修饰的聚苯乙烯(PS)细菌捕获微球和集成的声表面波(SAW)驱动源来模仿纤毛系统对细菌的捕获和清除过程,实现了细菌在浸没表面上的定向清除。他们的研究结果表明,在静电双层力和范德华力的作用下,经过正电修饰的PS微球可以有效捕获浸没表面上处于可逆粘附阶段的细菌以及浮游细菌。在SAW的作用下,PS微球将携带着被捕获的细菌远离浸没表面,有效防止细菌在浸没表面上的粘附。实验结果发现,在只加入一次粒子的情况下,单个电极的作用距离超过4 mm,抗菌效率在98.8%以上(玻璃基底)。此外,受益于SAW器件优异的集成性,所需要的细菌处理时间可以缩短至2 min。该策略为医疗器械、传感器、微流控等领域提供了一种主动的抗污方式,具有良好的发展潜力。
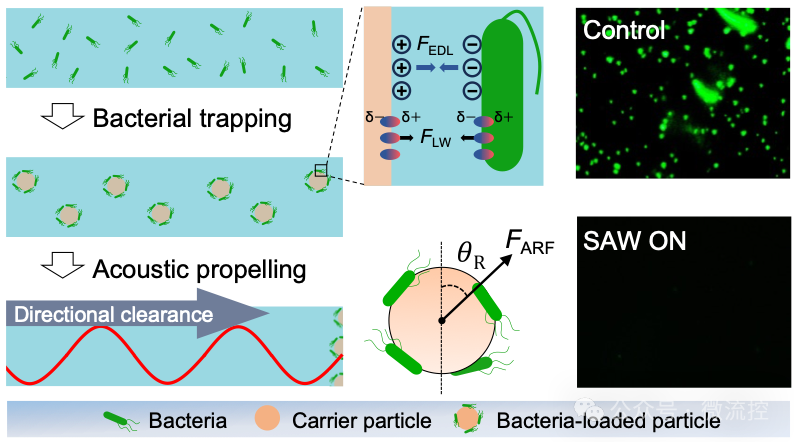
图1 图文摘要
本文首先介绍了SAW细菌定向清除系统的组成与作用机理。通过标准光刻技术,将金属叉指电极拓印在Y-X 128°铌酸锂基底上。在逆压电效应的作用下,施加在叉指电极上的正弦电信号将转化为沿着铌酸锂表面传播的弹性波。当SAW传播至液体层时,将以泄露波的形式与流场进行耦合,从而形成声流场。悬浮在声流场中的物质,会在声辐射力和声流曳力这两种长程力的作用下,表现出特定的运动模式。因此,向流场中加入的PS微球,会在声辐射力的作用下,沿着SAW传播的方向移动,如图2A和2B所示。按照经典的DLVO理论,细菌在表面上的粘附主要受到细菌与材料表面之间的静电双层斥力和范德华力吸引力的这两种短程力的影响。由于自然界中的细菌通常带负电,而PS微球表面经过羧基修饰带正电,因此细菌与微球表面之间的静电双层力表现为吸引力。因此,靠近微球表面的细菌会在静电双层力和范德华力的作用下被微球表面捕获,如图2C所示。细菌在被微球捕获后,将被SAW定向清除,远离受保护的浸没表面,从而防止了细菌的二次污染。图2D的细菌荧光染色图片验证了该系统对浮游细菌的清除效果。
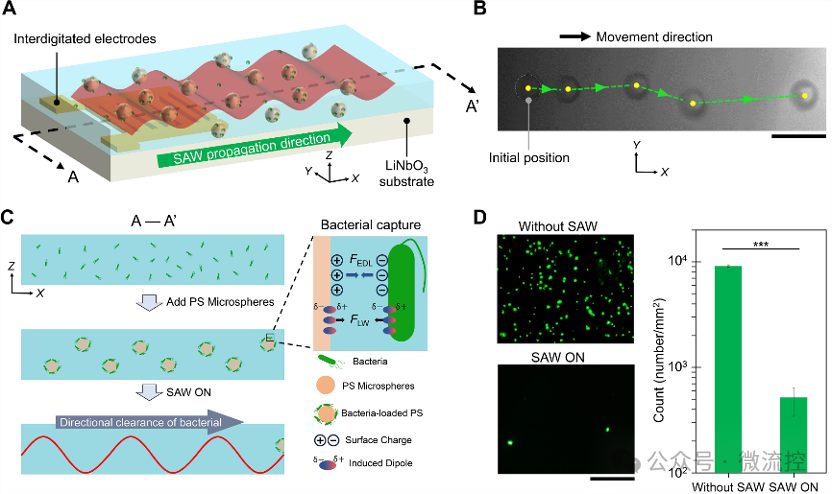
图2 SAW细菌定向清除系统的机理解释与效果表征。(A)抗菌系统示意图;(B)声流场对PS微球的定向驱动;(C)正电修饰的PS微球的细菌捕获机理;(D)清除浮游细菌的荧光染色实验。
通过分析和预测声流场中粒子的行为模式,研究人员建立了粒子的受力模型。在行波流场(TSAW)中,粒子主要有两种行为模式,一种是在声辐射力作用下,粒子沿着SAW传播的方向移动。另一种是在声流曳力的作用下,粒子跟随流场做周期性的旋转运动(图3A)。根据前人的研究,主导力是由一个无量纲常数Ktr决定的,当Ktr >1时,声辐射力将驱动粒子沿着SAW传播的方向定向移动。而Ktr与粒子的特征直径与SAW的波长有关。因此,需要对频率与粒子直径进行合理选择。这里,SAW的波长选择为280 μm,以保证SAW具有较远的传播距离。此时的临界特征直径为44.6 μm,为了保证声辐射力为主导力,选用半径为50 μm的PS微球作为细菌捕获颗粒,此时,声流场中的PS微球将在声辐射力的作用下沿着SAW传播的方向定向移动(图3B和3C)。
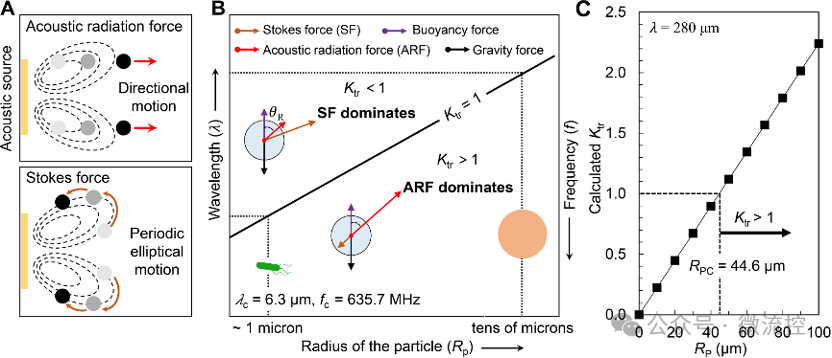
图3 声流场中的粒子受力模型。(A)声流场中两种粒子的行为模式;(B)粒子受力模型;(C)粒子行为预测。
图4A展示了经过正电修饰的聚苯乙烯微球对细菌的捕获能力。为了增强微球捕获细菌的能力,对最佳的粒子质量分数与捕获时间进行了优化。实验结果表明,质量分数为0.05%时细菌的捕获效果最好且不会发生粒子的堆积和聚集,同时,60 s的捕获时间足以将悬浮细菌有效捕获。研究人员还探究了三种电极对细菌捕获效果的影响。实验结果表明,相较于双向叉指电极和聚焦型叉指电极,单相单向叉指电极(SPUDT)在保证最少的能量耗散的前提下,可以覆盖更高的面积。如图4E所示,SPUDT的抗菌表现最好,对大肠杆菌和金黄色葡萄球菌的抗粘附效率达到了92.4%和95.5%。
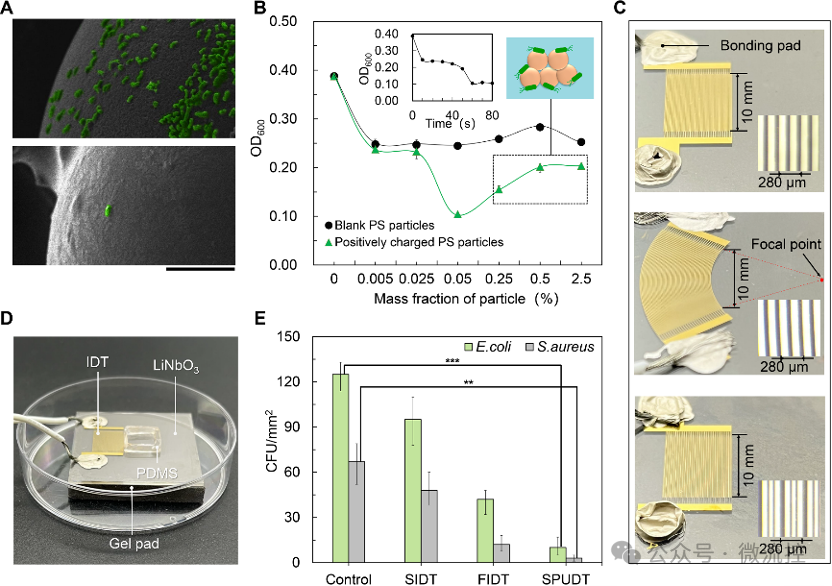
图4 影响细菌捕获效果的参数和电极优化。(A)细菌捕获效果表征;(B)粒子质量分数与捕获时间对细菌捕获效果的影响;(C)三种IDT的照片;(D)实验装置图;(E)电极类型对细菌捕获效果的影响。
图5展示了PS微球在声流场中的运动过程及受力。在峰峰值电压35 V下,PS微球的最高瞬时速度可以达到149.5 mm/s。随着SAW对PS微球的加速,作用在微球上的声流曳力最大可以达到91 Nn。由于实验中声陷驻场的产生,作用在微球上的声辐射力呈波动状态。在峰峰值电压35 V下,声辐射力最高可以达到142 Nn。
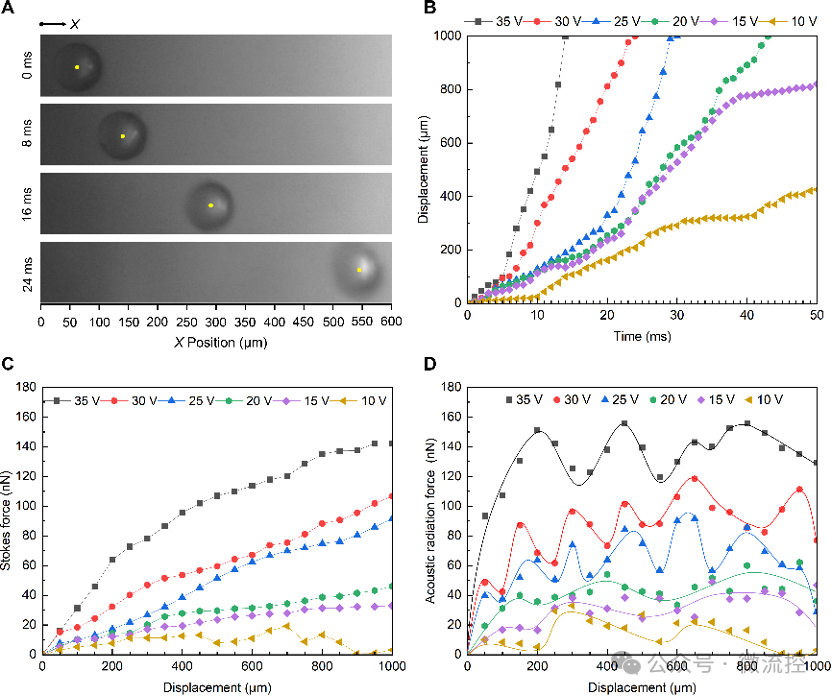
图5 声流场中的PS微球运动分析。(A)PS微球运动的时间序列图;(B)PS微球的运动分析;(C)作用在PS微球上的曳力分析;(D)作用在微球上的声辐射力分析。
图6和图7分别展示了SAW细菌定向清除系统对浮游细菌和浸没表面上的细菌的抗菌效果。对于在液体环境中的浮游细菌,单个电极的有效清除距离可以达到6 mm。以2-4 mm范围为例,在荧光显微镜的原位观察下,浮游细菌的数量相较于实验前降低90%以上。对于浸没表面上的抗细菌粘附,SAW细菌清除系统也展现出优良的性能。通过涂板实验和扫描电镜观测,可以证明该系统对大肠杆菌和金黄色葡萄球菌在浸没表面上的抗粘附率可以达到90%以上。相较于仅加入PS微球和仅开启SAW,两者同时作用所表现出的抗菌效率最高。这证明了整个抗菌功能是在微球的捕获和SAW的驱动的协同作用下实现的。此外,研究人员还探究了SAW持续时间和激发电压对有效抗菌距离的影响。实验结果证明,在浸没表面上的抗细菌粘附距离可以达到5 mm,所需要的激发时间仅为60 s,激发电压小于35 V。通过细菌活死染色实验,证明了该系统并不会造成细菌的原位死亡。
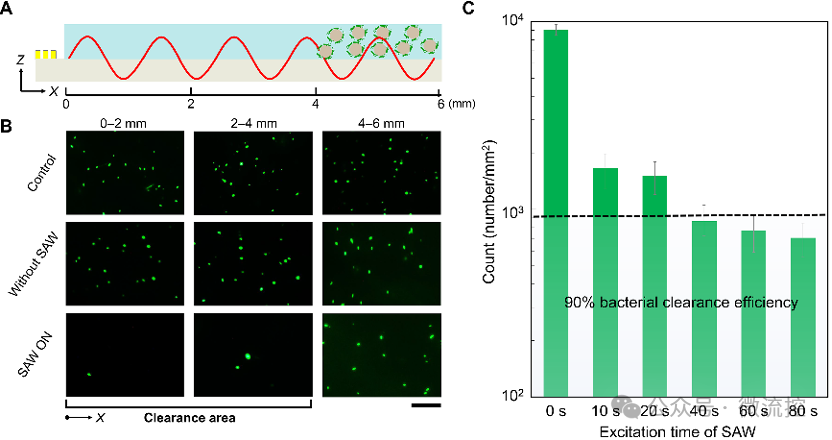
图6 有效抗菌距离的研究。(A)悬浮细菌的清除原理;(B)悬浮细菌清除的荧光原位表征;(C)在2-4 mm的典型距离内细菌数量的变化。
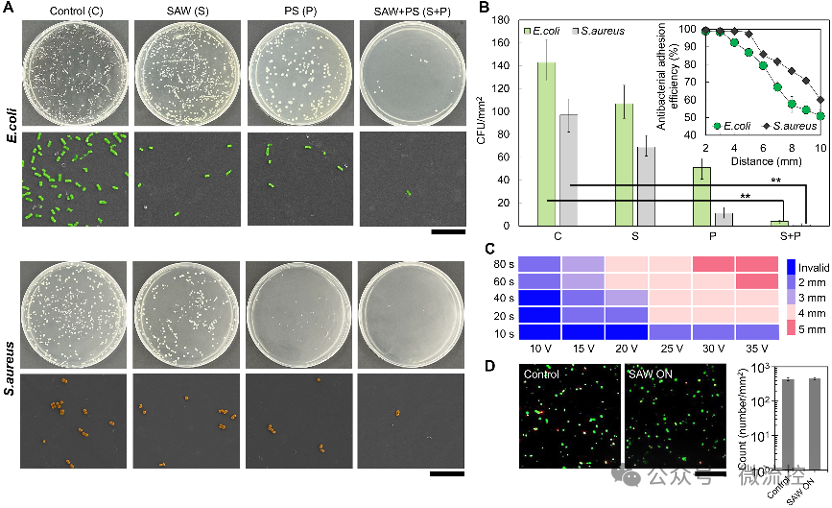
图7 浸没表面上的细菌清除效果表征。(A)细菌在浸没表面粘附的代表性SEM和涂板照片;(B)不同实验条件下的细菌粘实验结果;(C)SAW持续时间和激发电压对细菌清除效果的影响;(D)活死染实验验证SAW非杀死型抗菌。
该抗菌系统展现出良好的适应性与集成性。一种潜在的应用是防止细菌在植入性医疗器械表面上粘附。实验证明,该系统可以应用于抑制细菌在导尿管内壁(3D表面)与钛合金表面(2D表面)上的粘附超过8 h,防止生物膜的形成。
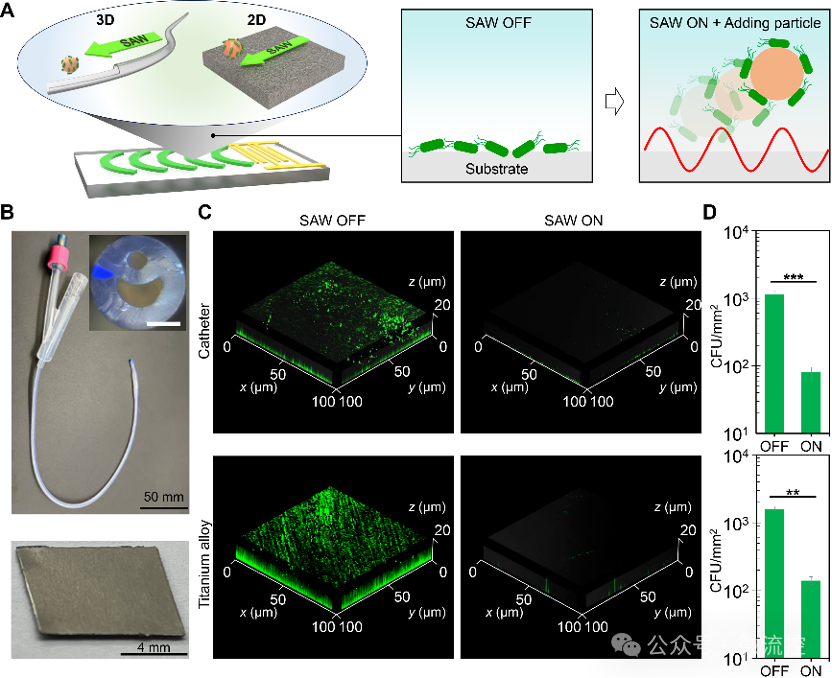
图8 浸没表面上的细菌清除效果表征。(A)导尿管内壁和钛合金表面上的细菌清除过程;(B)实验器材图片;(C)激光共聚焦表征的两种材料上的生物膜;(D)细菌在两种材料表面上的涂板计数结果。
以上相关工作以“SAW-driven directional clearance of bacteria on submerged surfaces”为题在国际著名期刊Chemical Engineering Journal上发表。该论文第一作者是大连理工大学机械工程学院博士研究生张智渊,大连理工大学机械工程学院张磊副教授、孙吉宁教授为通讯作者。该研究得到了国家自然科学基金以及大连理工大学青年教师启动基金的支持。
https://thezhangresearch.wixsite.com/zhanglab
https://faculty.dlut.edu.cn/sunjining/zh_CN/index.htm
https://doi.org/10.1016/j.cej.2024.156485
延伸阅读:
《即时诊断应用的生物传感器技术及市场-2022版》
