据麦姆斯咨询报道,近期,英国阿斯顿大学(Aston University)领导的一个国际项目开发出一种检测血液样本中癌症生物标志物的液体活检方法。这项技术已经发表于Nature Scientific Reports,可能对识别健康样本和癌症样本之间的显著差异至关重要。
该液体活检方法由阿斯顿大学光子技术研究所的Igor Meglinski开发,使用一种新的基于偏振的图像重建技术来分析干血样本中的多晶结构。
在癌症等疾病的早期阶段,血液中的这些蛋白质会改变其形状和组合方式。这一特性使该研究团队能够利用蛋白质独特的3D三级结构以及它们连接成四级结构的方式的变化来检测和分类不同的细胞。
Igor Meglinski评论道:“我们的研究项目为液体活检领域引入了一种开创性的技术,符合对非侵入性、可靠和高效诊断方法的持续追求。”
这项突破还与癌症生物标志物光学检测方面的最新进展相结合。2023年,光谱学开发商Dxcover描述了使用人工智能(AI)算法分析患者血液样本的红外光谱并检测是否存在癌症指示物,该公司打算将这种方法应用于八种不同类型的癌症检测。
革命性癌症诊断技术的巨大潜力
阿斯顿大学开发的技术利用了穆勒矩阵(Mueller matrix),这是一种数学建模方法,它通过偏振光在没有非线性效应的情况下的相互作用来表征样品的光学特性。
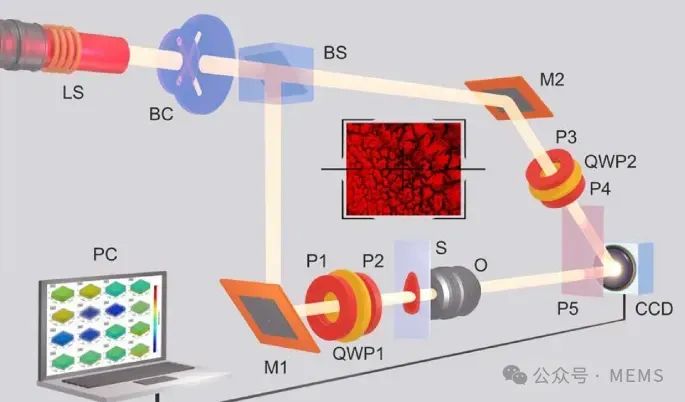
穆勒矩阵成像方法所采用的光学方案
来自数码相机的数据已经可以用来捕捉2D穆勒矩阵图像,即穆勒矩阵元素的二维分布,它可以揭示每个点的偏振特性信息。新的突破涉及使用633纳米干涉仪开发新型3D穆勒矩阵(3D MM)偏振测量技术,可以提供有关被成像蛋白质的3D信息。
该项目将其3D穆勒矩阵建模应用于从健康和患病志愿者身上采集的血液膜样本,并开发了一种分析协议,用于区分健康组织和异常癌性前列腺组织的3D穆勒矩阵数据。
这涉及对样本的光学各向异性图进行定量评估,表征双折射和二向色性分布等参数,并确定健康样本和癌性样本之间这些参数的显著差异。结果表明:“癌症早期诊断和分期的准确率超过90%,这超过了现有的筛查方法。”
“这一突破为癌症诊断和监测开辟了新途径,代表了个性化医疗和肿瘤学的重大飞跃。”Igor Meglinski评论道,“它具有彻底改变癌症诊断、早期检测、患者分层和监测的巨大潜力,从而大大改善了患者护理和治疗效果。”

