为应对这些挑战,来自美国马里兰大学的研究团队提出了一种混合增材制造方法,将数字光处理(DLP)3D打印与“异位直接激光写入(esDLW)”相结合,以实现用于流体微注射的新型微针阵列。相关研究成果以“Additive Manufacturing of Zn-Doped ZrO₂ Architectures”为题发表在Advanced Materials Technologies期刊上。
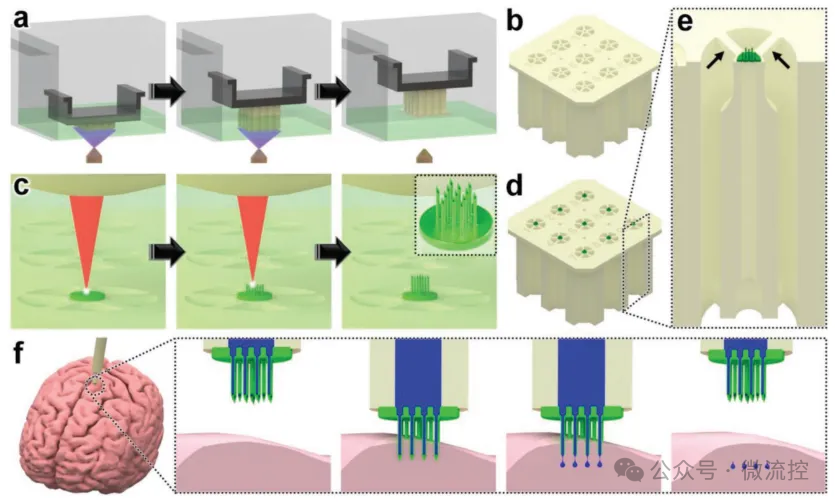
具体来说,研究人员首先利用Miicraft M50微流控DLP 3D打印机和Clear Microfluidics Resin V7.0a树脂3D打印制造毛细管的批量阵列,然后采用Nanoscribe Photonic Professional GT2 DLW 3D打印机和IP-Q光刻胶,通过esDLW方法将中空、高纵横比、高密度的MNA直接打印到DLP打印的毛细管上,并确保流体密封。之后,可以根据需要通过手动切断支撑结构,从批次中选择性地释放单个MNA-毛细管组件,然后将其与注射器系统连接,用于微注射应用。

为了展示这种混合制造策略的潜力,研究人员制造了具有高纵横比微针的阵列,这些微针的内径为30 μm,外径为50 μm,高度为550 μm,并且以100 μm的针间距排列,直接打印到DLP打印的毛细管上。实验结果显示,在超过250 kPa的输入压力下进行微流控循环爆发压力测试时,MNA-毛细管界面处的流体完整性没有受到影响(n = 100个循环)。
此外,研究人员还利用离体小鼠大脑进行了离体实验,结果显示,MNA不仅能承受穿透脑组织和从脑组织中缩回的过程,而且还能有效地将替代流体和纳米颗粒悬浮液直接微注射到大脑中。
为了评估esDLW打印的高纵横比MNA的机械性能,研究人员采用了数值和实验方法。有限元分析(FEA)结果显示,每个阵列中的微针都表现出类似屈曲的变形,最大位移出现在高度的中点附近;然而,位于外部区域的针(即径向排列距离MNA中心最远的针)表现出比位于中心阵列位置的针更大的变形。这种行为源于MNA的圆盘状底座引起的载荷分布,底座的中心区域比周边区域变形更大,从而使中心位置的微针在轴向上比外部区域的微针更坚硬地移动。根据FEA压缩载荷模拟产生的应力-应变曲线,整个MNA表现出4.31 MPa的有效杨氏模量(E)和135 kPa的屈服强度(σy)。研究人员还对与穿刺脑组织相关的MNA力学进行了数值模拟。通过表征微针尖端与脑基质之间界面处的非线性响应,他们发现位于外部区域的针所受的力大于中心区域的针,这与压缩载荷分析结果一致。
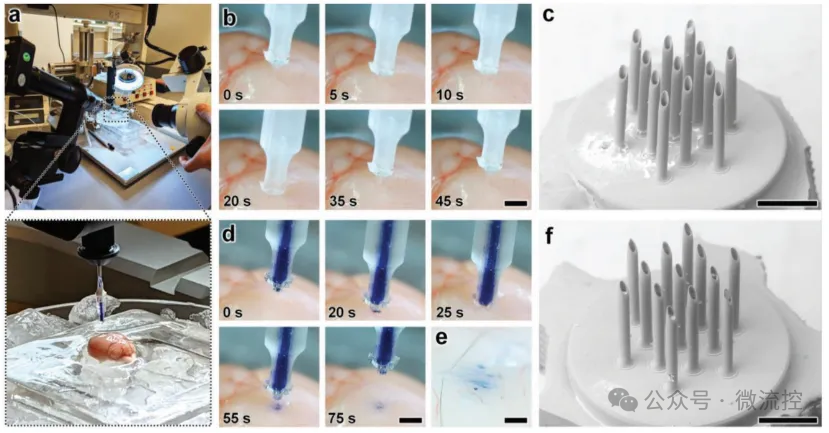
为了实验性地检验esDLW打印的MNA的机械性能,研究人员进行了两组与穿刺相关的研究。首先,他们使用esDLW打印的MNA进行了轴向压缩测试(n = 3),结果显示,随着载荷的增加,微针出现屈曲型变形,直到完全机械失效。从压缩测试后MNA的SEM图像中,他们观察到几个完全断裂的情况,但大多数阵列中的微针保持完整,只是针尖和针的整体形状表现出塑性变形。esDLW打印的MNA的应力-应变关系的量化结果显示,平均E为2.12 ± 0.35 MPa,σy为155 ± 30 kPa。
然后,研究人员还研究了esDLW打印的MNA穿刺和穿透具有不同浓度琼脂糖的替代水凝胶的能力,这些水凝胶对应于不同程度的生物相关硬度。实验结果显示,MNA成功穿透到1.2%、2.4%和5%的琼脂糖凝胶中;然而,在10%琼脂糖凝胶中观察到微针屈曲和未能穿透的情况。这些结果表明,esDLW打印的MNA足以穿透脑组织以及其他各种组织(例如,肝脏、乳腺、心脏、肾脏、动脉和前列腺组织),但对于涉及目标介质E超过250 kPa的微注射应用,则需要替代光材料(具有更强的机械性能)和/或具有几何增强强度(例如,通过增加外径)的微针。
最后,研究人员评估了esDLW打印的MNA与传统上广泛用于向脑组织递送治疗剂的针头(Hamilton 33G)相比的微注射性能。他们使用荧光标记的纳米颗粒(直径100 nm)悬浮液作为替代微流体有效载荷。作为esDLW打印MNA的初始阳性实验对照,他们在体外将纳米颗粒悬浮液微注射到0.6%琼脂糖凝胶中(n = 3个MNA),并使用双光子和宽场荧光显微镜观察颗粒分布。他们观察到阵列中每个微针对应的注射纳米颗粒,其中包括阵列中心的一个微针,径向排列在中间区域的六个针(距离中心150 μm),以及径向排列在外围区域的六个针(距离中心260 μm)。
总之,这项研究提出了一种混合增材制造策略,该策略将数字光处理(DLP)3D打印与异位直接激光写入(esDLW)相结合,以制造用于流体微注射的新型微针阵列(MNA)。通过结合这两种技术,研究人员成功地制造出了由中空、高纵横比微针组成的高密度阵列,展示了其在脑组织微注射中的应用潜力。这项研究为未来开发用于各种生物医学应用的定制化MNA提供了重要基础。

