当前,为实现个性化医疗健康管理,研究人员已开发出一系列电化学生物传感器,以实现对靶标生物分子的即时、快速、便捷检测,从而将临床检测从专业实验室扩展到公共场所。目前,美国食品药品监督管理局(FDA)批准的生物传感器主要局限在血糖监测仪和心血管监护仪两大类。虽然已有多种电化学传感器能够准确、灵敏、特异性检测一系列生物体液(例如血清、尿液、汗液、唾液和脑脊液等)中与疾病相关的代谢物分子,但由于难以将器件集成化和小型化,其临床转化仍然受限。
据麦姆斯咨询报道,来自华中科技大学同济医学院附属协和医院的研究人员在《中国生物工程杂志》上发表了题为“新型电化学传感器在生物分子检测中的研究进展”的综述性文章,从电化学生物传感器与数字医疗健康结合的角度出发,详细讨论了便携式、植入式和可穿戴新型电化学传感器在疾病相关代谢物检测方面的研究进展,并对其临床转化和商业应用潜力进行了初步探讨。
便携式电化学传感装置
体外诊断(IVD)是指对人体样本(血液、体液及组织)进行定性或定量检测,进而判断疾病或机体生理功能的诊断方法。目前IVD已经成为疾病预防、诊断治疗必不可少的医学手段,提供了约80%的临床诊断信息。电化学传感器凭借其固有优势,在IVD领域具有巨大的应用潜力,尤其是当代智能手机驱动的无线数据传输,更为传感装置的智能数字化分析拓宽了道路。
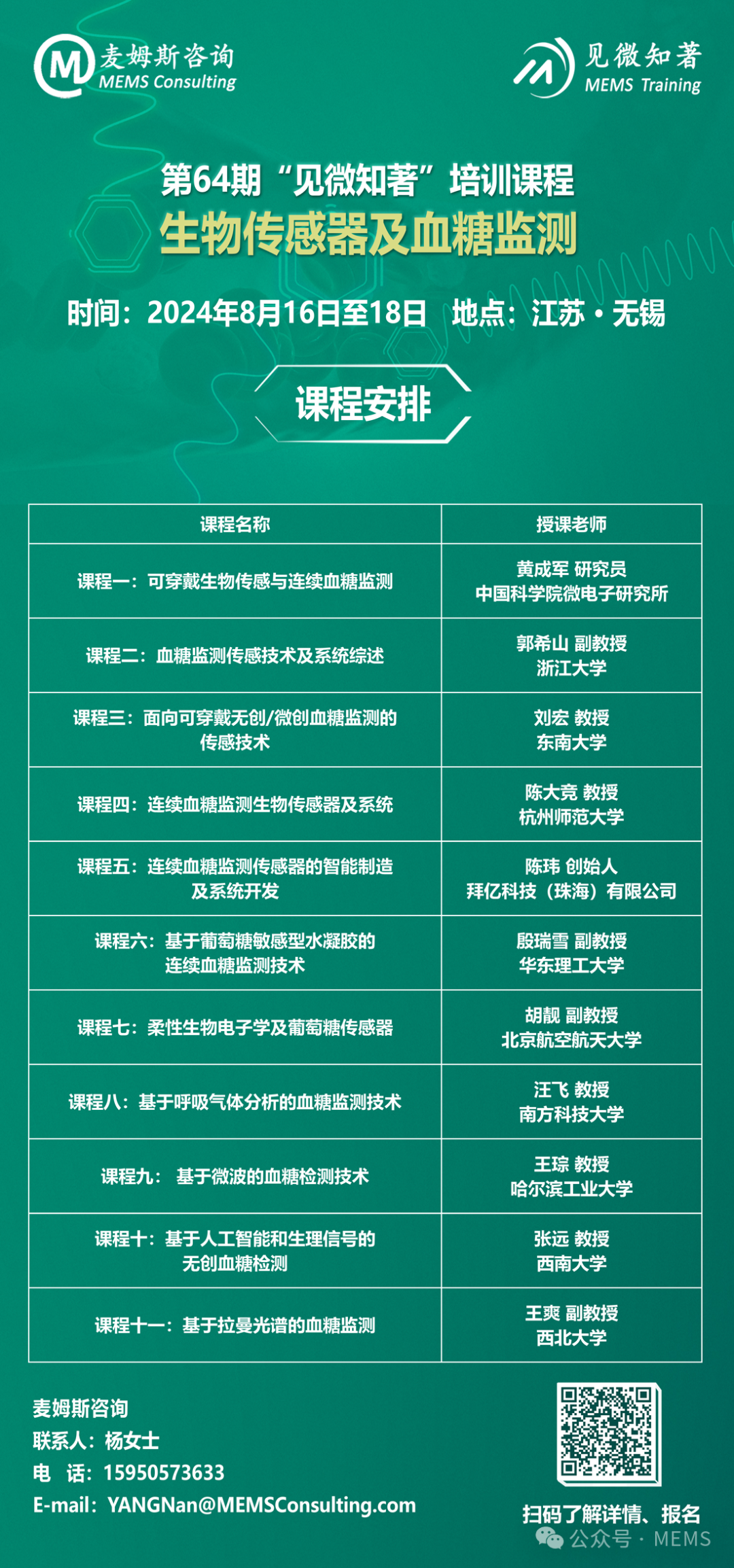
如图1所示,Fiore等设计了一种简易便携的小型酪氨酸测定仪,由一次性丝网印刷电极(SPE)试纸和手持式恒电位仪EmStat3 Blue组成。SPE包括透明的柔性聚氨酯载体、石墨基油墨构成的工作电极和辅助电极以及银基油墨构成的参比电极,其中工作电极表面还修饰了炭黑粉末以提高传感精度,能在生理缓冲液中准确测定30~500 μmol/L范围内的酪氨酸,灵敏度为0.043 μA·L/μmol,检测限低至4.4 μmol/L。
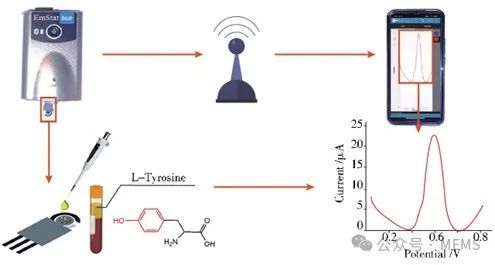
图1 智能手机辅助的便携式酪氨酸测定仪示意图
人血清样品经过滤洗脱去除干扰物质色氨酸后即可滴加到SPE表面进行孵育,由EmStat3 Blue测量获得的伏安数据可通过蓝牙传输到智能手机的PStouch应用软件中进行计算分析并输出酪氨酸浓度,操作便捷且用时少于10 min。但该装置不适用于全血样本的直接分析,甚至依赖于吸附柱预处理来去除血清中的电活性干扰物质,因此还有待改进。但是,SPE和智能手机辅助的恒电位仪的有机整合使该方法具备独特的经济、技术和生态优势。
植入式电化学传感装置
便携式电化学装置的使用依赖于频繁、有创的样本采集,而植入式生物传感器具有连续监测能力,能连续测定体内某些随时空变化的重要生理或病理参数,例如葡萄糖、乳酸、钙离子或氧浓度等,尤其适用于脑内生物标志物,例如神经递质多巴胺和5-羟色胺(5-HT)的体内监测,可提供神经元活动的动态信息。
植入式传感器的电极通常由生物相容性材料制成,但作为异物,难以完全避免生物污染和异物反应。由于宿主将多数植入传感器视为“异物”,在伤口愈合过程中触发复杂的级联免疫信号:纤维蛋白原和其他蛋白质与植入物表面结合,然后吸引巨噬细胞迁移到局部,释放炎性细胞因子,从而刺激静止的成纤维细胞转化成肌成纤维细胞以合成前胶原蛋白。前胶原蛋白交联成熟后与其他细胞外基质蛋白形成一个致密的纤维囊,包裹住植入的“异物”,阻碍物质扩散,严重影响了生物传感器和药物/细胞递送装置等器件发挥正常功能。
例如,动态血糖监测仪因纤维化包裹和生物污染导致的噪声,需要进行每日校准,使用期限仅7~14天。减轻或消除异物反应不仅可以提高传感器的检测性能,也能延长其使用寿命,更能有效避免局部炎症和纤维化反应。因此,电极外部最好涂覆有用于防止传感器结垢的生物相容性层。例如,内源性气体小分子一氧化氮(NO)能抑制血小板黏附和活化、炎症反应和细菌生长,因此,在器件表面修饰释放NO的聚合物涂层可以有效改善传感器的生物相容性。
除了生物污染对检测性能的不利影响,分析物本身的电氧化产物在电极表面富集也是电极结垢和传感器信号衰减的原因之一。5-HT是一种具有良好电活性的兴奋性神经递质,可以在碳电极表面直接氧化形成电流,但随着氧化反应的发生,产物迅速电聚合,低聚物通过π-π堆积作用强烈吸附在电极表面,这种结垢效应大大降低了电流响应和灵敏度,使电流型传感器失效。
因此,Zhu等提出了一种无氧化还原反应的电位传感平台(GRP),用于活体动物脑内5-HT的自驱动传感。该GRP系统包括对5-HT敏感的阳极指示电极和嵌入K₂IrCl₆溶液中的阴极参比电极,只有当指示电极上发生分子识别,在双极体系中形成具有净负Gibbs自由能的电路时,传感器才能在静态条件下产生浓度依赖性开路电位响应。
关键点在于,GRP系统工作环境接近零电流,因此在测量期间造成的氧化反应最弱,有效减少了常规安培传感器在5-HT检测时容易出现的电极钝化。此外,由于电势输出和分析物浓度符合能斯特方程,GRP传感器的灵敏度与电化学表面积无关,进一步消除了生物环境内丰富的蛋白质对电极的潜在生物污染效应。如图2所示,植入豚鼠的背侧中缝核(DRN)后,该GRP系统能在50 s内准确检测到高K⁺刺激(70 mmol/L)诱导的5-HT内源性释放,充分证明了植入式传感器在活体内优异的时空分辨率。
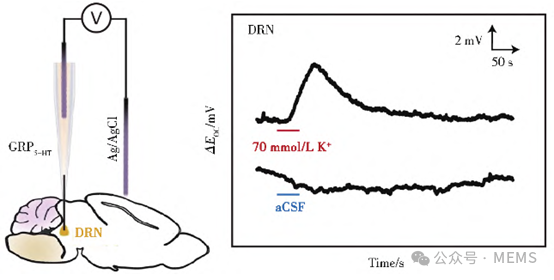
图2 GRP系统植入活体豚鼠脑背侧中缝核内的传感示意图
目前,部分植入式电化学生物传感器已经进入商业化时代。例如,Senseonics公司生产的Eversense E3皮下植入式动态血糖仪于2022年获美国FDA批准上市。与多数连续血糖监测仪的构造相同,Eversense E3由传感器和发射器组成,通过蓝牙将血糖信息传输到移动设备中,能够提供长达180天的动态血糖值;Neuralink公司发明的植入式脑机接口设备通过在大脑中植入电极丝来“读取”脑电波信号,有望“解码大脑”以解决阿尔茨海默病、脑卒中、癫痫等脑部疾病。总之,作为组织与电子的接口,植入式传感器在生物电子医疗领域发挥着重要作用。
柔性可穿戴无线电化学传感装置
近年来,柔性可穿戴传感器与远程医疗和精准医疗等概念相互贯穿,能主动、远程监测多种理化参数,显著提高了佩戴者的自我监测依从性和护理质量。目前,市面上的无创可穿戴传感器多与智能手表、手镯和隐形眼镜集成,主要集中在体温、心率、血压、血氧和葡萄糖等单个物理或生化参数的监测。电化学检测技术凭借其灵敏度高、成本低、制作速度快、易于小型化等优点在该领域得到广泛应用。
与目前用于实时监测的组织间质液、唾液、泪液相比,汗液最容易获取,其可以在皮肤表面通过运动、加热、压力、药物或离子刺激等非侵入性方式来采集。此外,汗液含有丰富的反映新陈代谢状况和疾病程度的理化标志物(包括电解质、代谢物和药物),与血浆水平具有良好的相关性。因此,在各类可穿戴生物传感器中,通过与皮肤共性接触的表皮可穿戴生物传感器最受关注,其可以对汗液中的生物标志物进行实时分析,提供无创的动态健康监测。
汗液采样在可穿戴生物传感中起重要作用,其物质浓度受多重因素影响,包括重吸收、蒸发、分泌速率、运动、情绪和分泌腺代谢等。微流控技术可以最大限度减少汗液污染、重吸收和蒸发,提供高时空分辨率的汗液动力学,已成为当下主流的采样系统。
如图3所示,Wang等设计的NutriTrek皮肤贴片型传感装置通过离子电渗模块透皮递送卡巴胆碱,按需刺激局部汗液产生,收集的汗液进入多入口微流控模块后到达传感区域进行原位分析。NutriTrek系统能与具有电子显示器的智能手表集成,并通过Na⁺和温度实时校准,准确监测汗液中9种必需氨基酸、常见维生素、代谢物、脂质、激素、药物等,实现了超广泛的生物标志物选择性检测,对个性化营养和精准治疗具有重要意义。
图3 NutriTrek装置图像及结构模块示意图
类似地,通过将激光雕刻石墨烯(LEG)传感阵列与离子电渗和微流控模块结合,该团队又开发出针对汗液中C反应蛋白(CRP)的InflaStat系统,检测限低至8 pmol/L。当受控诱导的汗液进入微流控装置时,检测抗体(dAb)缀合的AuNPs在试剂储存池内重悬并与汗液沿蛇形通道被动混合以促进汗液CRP与dAb之间的动态结合。随后,混合物在检测室内与固定抗CRP捕获抗体的LEG-AuNPs工作电极结合并被后续流入的新鲜汗液冲洗去除。cAb-CRP-dAb形成的“三明治”夹心结构能有效放大该检测器的灵敏度,实现了痕量水平汗液CRP分析(0~20 ng/mL)。这种自动微流控模块能够消除受试者出汗速率对电化学响应的影响,保证了检测结果的可靠性和不同佩戴者、不同检测时间点之间的可比性。
挑战与展望
综上所述,电化学生物传感器是定量分析体液中各种代谢物质的有力工具,具备装置简单、操作便捷、灵敏度高、响应速度快等优势,能为基础研究和医疗应用提供可靠的检测结果。将电化学生物传感器集成到便携式、植入式和可穿戴设备中可实现多重便捷检测,有望改善资源匮乏地区的检验诊断和健康管理方式。
然而,要使电化学生物传感器真正应用于临床诊疗,仍需致力于提高器件性能。例如,需要改进信号传导、调节(放大和过滤)、处理和无线传输方式以实现高灵敏度和网络化;需要尽可能将所有功能控制器和模块集成在一块电路板上以使传感器微型化;需要优化柔性电子器件和芯片组的封装等。
此外,飞速发展的智能手机、5G通信和云计算服务可以通过无线通信技术(例如蓝牙和近场通信)将电化学生物传感器获得的信息数字化,并与集成生物传感器的便携式、植入式和可穿戴设备形成闭环数字化医疗系统。随着市场渗透率的提高,电子传感器必然会产生大量的个人数据,因此必须研究下一代算法以保护数据安全和用户隐私。未来,多模态传感器与人工智能和机器学习的整合,必将进一步推动生物传感器在医疗健康领域的快速发展。
论文信息:
DOI:10.13523/j.cb.2310039