隐球菌是一种主要通过呼吸道感染的真菌病原体,已传播遍布70多个国家。对于免疫功能低下的人群,如器官移植患者和癌症患者,隐球菌感染尤为广泛。由于隐球菌引起的症状与肺炎等并发症非常相似,这使得临床诊断变得困难,从而容易耽误治疗,严重时还可能危及生命。因此,大范围筛查疑似病例,及时准确识别隐球菌感染,对于感染控制非常关键。
传统的隐球菌检测主要依赖于实时荧光定量PCR技术,这种方法准确性很高。然而,由于需要昂贵的仪器设备来实现精密温控,限制了其广泛应用。等温扩增技术提供了更加简便的检测手段,但相对较低的准确度和灵敏度限制了其在精准定量分析中的应用。
针对上述挑战,北京航空航天大学医学科学与工程学院董再再、牟玮等人合作,报道了一种新型微孔阵列芯片平台,集成了基于深度学习的智能图像识别技术,能够快速、精确地定量检测隐球菌感染。相关成果以“Deep learning - enhanced microwell array biochip for rapid and precise quantification of Cryptococcus subtypes”为题,发表在《VIEW》期刊上。
论文通讯作者为北京航空航天大学董再再助理教授、牟玮教授、常凌乾教授,以及首都医科大学附属北京世纪坛医院薛新颖主任。第一作者为北航硕士研究生童一航、曾雨、卢一诺,以及首都医科大学附属北京世纪坛医院博士研究生黄叶梅。

这种微孔阵列芯片设有四个微孔阵列区域,预装了CRISPR-Cas12a系统,可针对覆盖90%隐球菌感染的两大主要亚型进行靶向检测。微孔的紧凑空间有利于加快反应进程,将检测时间从60分钟(试管内检测)缩短至10分钟以内(片上检测)。此外,结合SAM(Segment Anything Model)大模型技术,该研究能够自动精准分析智能手机拍摄的芯片检测结果的荧光图像,实现对微孔位置的精确定位和病原体浓度的定量检测(检测限低至0.5 pM),在隐球菌样本检测中达到100%的高准确率,为大规模感染筛查提供了高性能的解决方案。
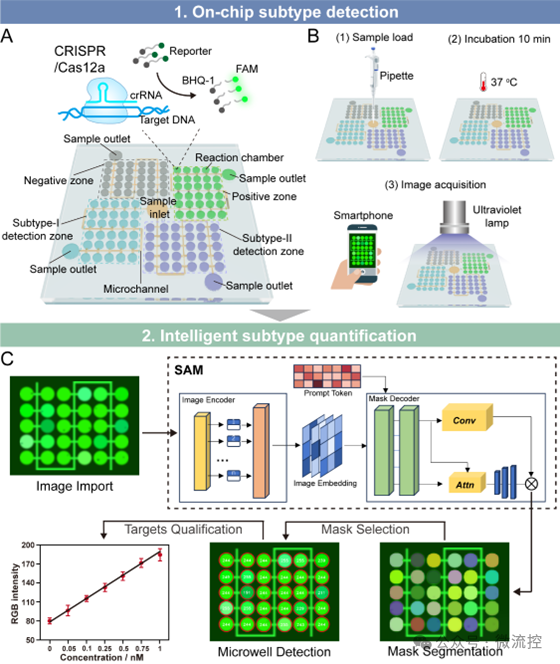
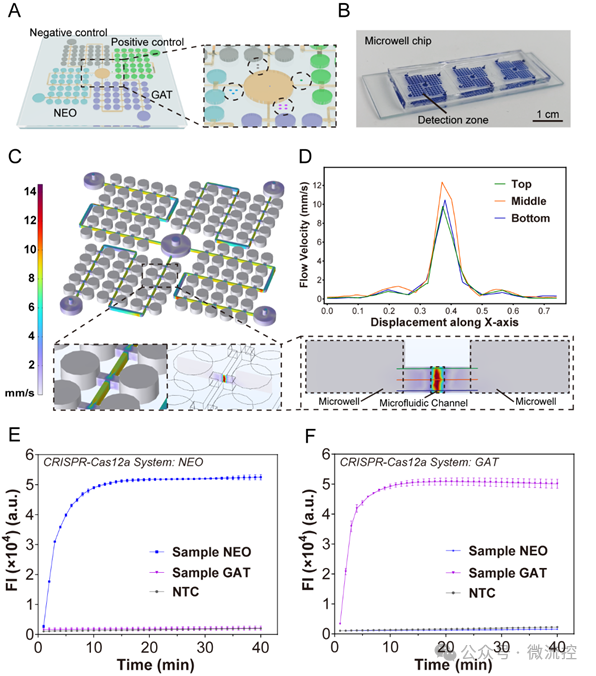
为验证该系统在隐球菌亚型检测中的性能,研究人员在芯片上构建了四个微孔阵列区域,分别加载了相应的CRISPR-Cas12a系统,用于隐球菌两种亚型(新生隐球菌(NEO);格特隐球菌(GAT))和两个对照组的检测(图2)。每个微孔阵列上标有不同数量的标志点,以便区分检测区域。实验结果表明,当微孔内充满溶液时,微流控通道内的溶液流动不会干扰微孔内溶液的静止状态,也不会导致试剂流失。此微孔结构还为CRISPR-Cas12a反应提供了紧凑的空间(40 nL),从而加快了反应速度,将总检测时间从60分钟(试管内检测)缩短到不到10分钟(片上检测)。同时,当在系统中加入非匹配的样品序列时,荧光信号与阴性对照组保持一致,表明系统具有高度的特异性。
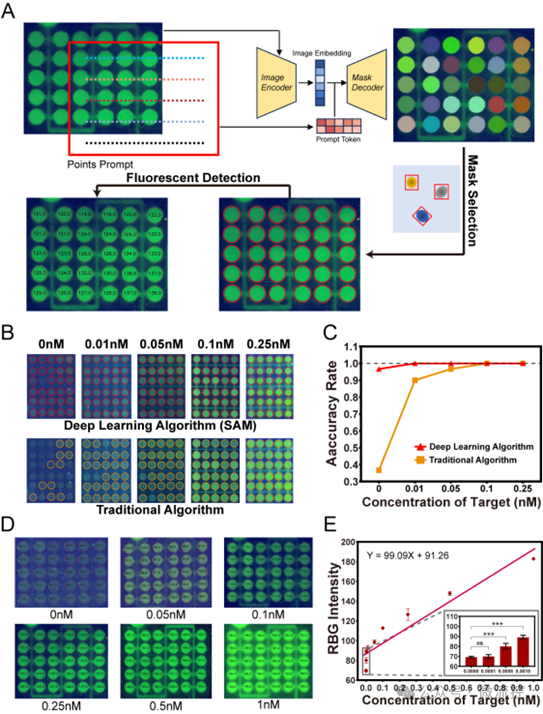
智能手机拍摄的微孔阵列荧光图像因分辨率低和伪影影响,难以实现对病原体的精准定量分析。针对这一挑战,研究团队研发了一种智能图像识别算法(图3)。该算法以SAM大模型为基础,结合点阵提示生成微孔的初步分割掩码,并依据圆形相似度来筛选出有效的掩码,从而实现对微孔的精准识别。随后,算法通过对识别出的微孔区域内的荧光强度进行加权平均处理,并建立不同浓度目标物与微孔平均光强的标准线性关系,从而实现未知样品浓度的精准量化。较传统计算机视觉方法,该算法在处理低浓度、低分辨率图像的识别与量化方面展现出更优越的性能。
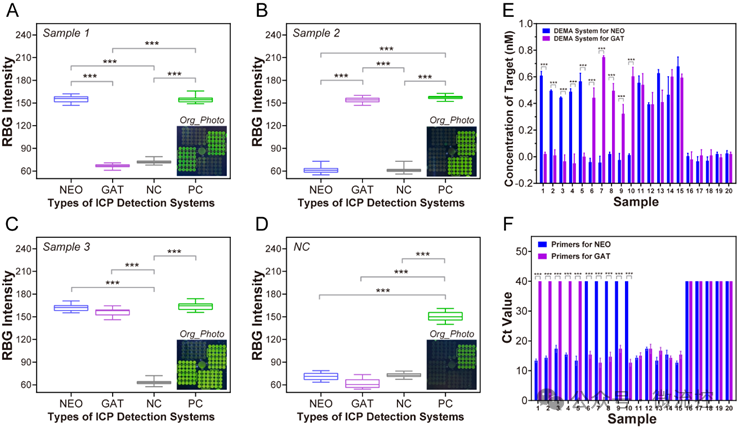
基于该系统,研究人员对三种具有代表性的隐球菌样本进行了检测,包括NEO阳性样本(5个)、GAT阳性样本(5个)和双重感染样本(5个)(图4)。同时,研究人员还检测了阴性对照样本(5个)。通过对智能手机拍摄的图像进行分析表明,系统能够准确识别隐球菌的亚型。此外,基于深度学习的图像识别程序给出的RGB结果可准确量化每个样本中隐球菌的浓度。与PCR检测结果相比,芯片系统在隐球菌定量分析方面显示出高度一致的浓度趋势,准确性达到100%;此外,该系统在快速检测(10分钟 vs. 60分钟)和样本用量(40 nL vs. 2 μL)方面的突出性能,相较于PCR,在便携式诊断中展示出明显优势。
目前,该技术正在联合首都医科大学附属北京世纪坛医院进行转化和临床试验。

