近期,来自华中科技大学和武汉大学的研究人员报告了一种小型化、高精度、完全集成的可穿戴电化学微针传感装置,该装置与定制的智能手机应用程序一起工作,以无线和实时监测人体ISF中的葡萄糖。相关研究成果以“An integrated wearable differential microneedle array for continuous glucose monitoring in interstitial fluids”为题发表在Biosensors and Bioelectronics期刊上。

研究背景
糖尿病是一种影响全球数亿人的慢性代谢性疾病。实时准确监测血糖水平被认为是糖尿病管理的金标准。目前许多研究都集中在非侵入性监测上,例如通过电化学或光学方法检测皮肤表面的血糖水平。然而,这两种方法在实际应用中都面临着重大挑战。此外,人们发现相对于血液,在汗液中观察到葡萄糖浓度变化明显延迟。这些挑战制约了非侵入性电化学传感的临床发展。对皮下间质液的直接分析为前面提到的挑战提供了一个有前途的解决方案。微针(MN)技术采用微米大小的针,能够穿透皮肤进入组织液。这种方法有利于无痛和非侵入性的葡萄糖检测。
设计思路
作者设计了一种可穿戴电化学微针传感装置,用于连续监测人体ISF中的葡萄糖。该装置由一次性微针传感器和可重复使用的电子设备组成。插入表皮的微针连续收集佩戴者的ISF的葡萄糖信号,并通过电子设备无线传输到用于可视化和分析的应用程序。与一次性成型微针不同,作者将微针和底座分开制造,然后组装。这种微针是由导电的商业不锈钢针灸针制成的。采用印刷电路板(PCB)工艺制备了带微孔的微针底座,并将微针嵌在微孔内。微针之间的连接设计在PCB内部。这种方法理论上允许微针阵列的每个微针作为一个单独的电极,这使得在一个小尺寸的微针阵列上制造多个传感器成为可能。此外,建立了微针穿透人体皮肤的有限元模型,分析了微针结构和间距对穿透效率和穿透力的影响。最后,对完全集成的微针传感系统进行人体测试。
研究内容
该集成系统利用突破表皮的微针传感器量化间质液(ISF)中的葡萄糖水平(图1a)。该方法利用普鲁士蓝检测过氧化氢(图1b)。该系统由七个不同的子组件组成,分为两个主要单元:“一次性微针传感器”和“可重复使用的电子设备”(图1c)。低成本的微针传感器可以很容易地根据其使用寿命进行更换。更换不同厚度的组件(支架A),可以调整微针的长度(图1d)。图1e描述了电化学三电极系统测量葡萄糖的工作原理。该系统结合了葡萄糖和差分传感器,后者未被葡萄糖氧化酶修饰,因此作为校正电极显示干扰信号。葡萄糖传感器中的干扰信号可以通过校正电极分离。所得电压通过蓝牙传输到智能手机,由应用程序处理并将其转换为葡萄糖浓度(图1f)。微针阵列由针灸针(直径160 μm)和PCB板构成,在PCB内部建立电气连接并延伸到背面,暴露的电极触点连接到电子器件(图1g)。
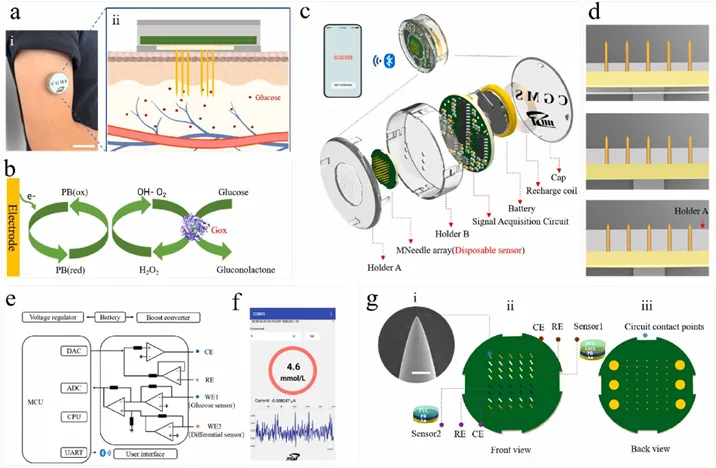
图1 基于差分微针及其子组件的可穿戴葡萄糖传感器系统的概念
图2a说明了微针传感器的基本结构和制造过程。每根直径为160 μm的针灸针被切成3 mm长度,并在带有微孔的底座上排列成5 × 8列。通过调整“支架A”(图1d),所用微针的实际长度为1 mm,底座直径为15 mm,厚度为1 mm。相邻微针之间的间距分别设置为1 mm和1.5 mm。葡萄糖传感电极是通过将金、普鲁士蓝、葡萄糖氧化酶(GOx)和Nafion连续分层到微针上来制作的(图2a、b)。差分传感电极的构造类似,但没有葡萄糖氧化酶修饰。参比电极是通过将商业Ag/AgCl安装到微针上而制成的。这种集成的微针底座组件可确保有效的皮肤渗透和设备的耐用性。与传统技术制成的圆锥形针相比,圆柱形针灸针具有卓越的穿透效率,并且需要更小的力。在猪皮上评估微针阵列的机械强度,压力-位移曲线(图2c)表明刺穿皮肤所需的压力约为4.75 N,相当于实际应用中佩戴者施加的温和压力。
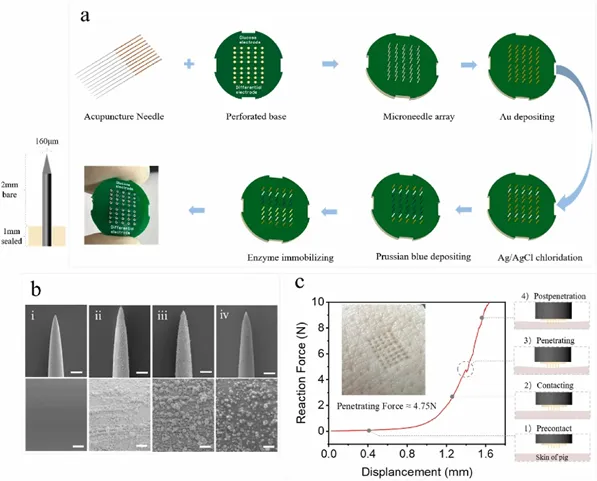
图2 微针传感器的制备与表征
葡萄糖传感器的检测机制利用普鲁士蓝(PB)来识别过氧化氢(H₂O₂),H₂O₂是葡萄糖氧化酶分解葡萄糖的副产物。在循环伏安(CV)扫描过程中,修饰PB的微针电极具有显著的氧化还原峰,这是PB晶体中铁的氧化还原(图3g)。图3b显示PB电极的H₂O₂还原发生在0.1至-0.1 V范围内(相对于Ag/Ag/Cl)。最佳工作电位由H₂O₂浓度增加时的电流响应和灵敏度决定。通过CV方法扫描50个循环来研究PB电极的稳定性,在第10个和第50个循环后,阳极峰值电流分别保留了原始电流的94.26%和86.04%(图3d)。相同条件下,阴极峰值电流保持率分别为98.68%和93.85%。在PB电极上进一步修饰葡萄糖氧化酶制备葡萄糖传感器。图3e显示了葡萄糖传感器在PBS溶液中连续添加1 mM葡萄糖时的电流响应,在0-15 mM浓度范围内的灵敏度为77.721 nA mM/mm²,线性相关系数(R²)为0.9987。在临床实践中,糖尿病的血糖值定义为空腹时大于7.0 mM,餐后2小时大于11.1 mM。因此,葡萄糖传感器可以满足糖尿病监测的要求。葡萄糖传感器在低浓度范围(0-100 μM)也表现出良好的电流响应(图3g),其检测限为36.437 μM,显示了传感器的高灵敏度。
本研究介绍了一种差分传感器策略,通过有效区分葡萄糖特异性信号和干扰诱导电流来提高葡萄糖检测的准确性。缺乏葡萄糖氧化酶修饰的差分传感器只捕获干扰电流,而葡萄糖氧化酶修饰的电极同时记录葡萄糖和干扰电流。从葡萄糖传感器的读数中减去差分传感器的读数,分离出纯葡萄糖信号。作者首先将两个传感器制作在同一批PB电极上,使电极间误差最小。其次,通过电路进行差分信号处理,保证处理的可靠性(图1e)。最后,将两个传感器浸入相同的电解质溶液中,使用双通道电化学工作站进行校准和抗干扰测试。在引入干扰物质后,校正后的葡萄糖传感器电流响应与葡萄糖浓度呈较强的线性相关,Pearson相关系数为0.9882,显著高于未校正时的0.5617,抗干扰能力有了明显提高(图3h)。
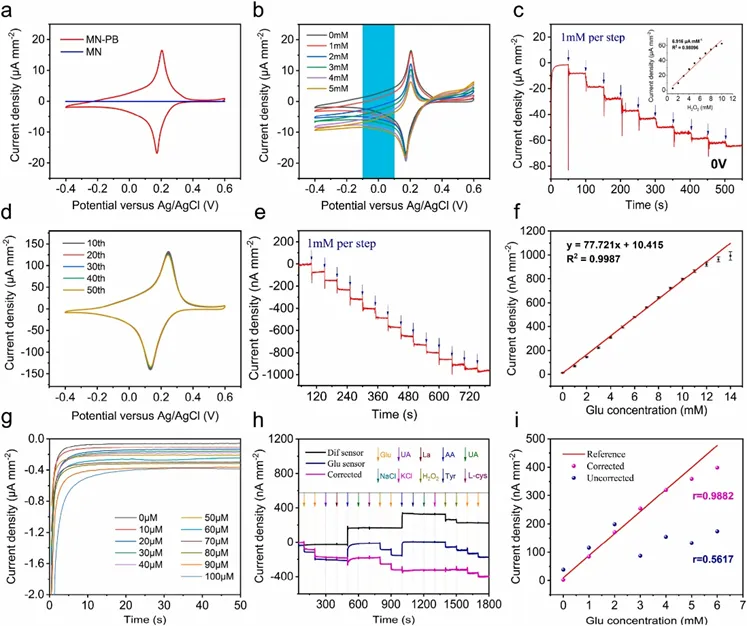
图3 微针传感器的体外电化学性能表征
如图4a所示,通过数值模拟,作者评估了穿刺效率,计算方法为皮肤穿透深度(Lp)与微针长度(L)之比。研究结果表明,圆柱形针头的穿刺效率为81%,超过了传统锥形针头的穿刺效率。微针的机械性能通过微针与皮肤之间施加的力表征。最初,微针穿过角质层进入真皮层,穿透所需的力瞬间降低。在第二阶段,微针进入真皮层,微针的侧壁接触皮肤。刺入过程一直持续到微针底部接触表皮,作用力急剧增加,进入第三阶段。在第三阶段,即使持续施加压力,微针也不会深入真皮层。因此,将微针刺穿皮肤所需的力定义为第三阶段开始时测量的力。如图4b所示,圆柱针为0.321 N,常规锥形针为0.495 N。这种减小的力可减少皮肤变形并提高穿刺效率。此外,图4c显示了不同间距微针阵列穿透瞬间的皮肤应变分布。当微针间距设置为0.25 mm(i)和0.5 mm(ii)时,观察到MN基底与皮肤表面之间的中间针周围有明显的间隙,导致穿透效率降低。然而,随着间距从0.75 mm增加到1 mm(iii、iv),皮肤应变分布的变化逐渐减小。特别是在图4c(iv)中,微针之间的穿透效率差异很小,这表明间距的影响可以忽略不计。
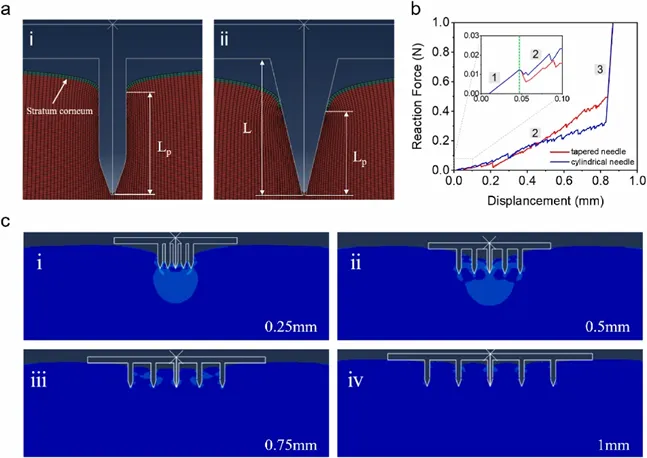
图4 评估微针的几何形状和间距对穿透效率的影响
差分微针阵列传感器的体内性能如图5所示。如图5b所示,进食后,每隔3 min监测一次的参与者的ISF血糖水平迅速上升,并在30-60 min内达到峰值,然后逐渐下降到原始基础值。使用Clarke误差网格对两个数据集进行分析(图5c)。位于临床可接受误差区A(对临床作用无显著影响)的数据点为89.47%,临床可接受误差区B(对临床结果影响较小)的数据点为10.53%,表明可穿戴差分微针传感器在准确连续跟踪体内动态葡萄糖波动方面的强大性能。在葡萄糖峰值强度(8.5-9.8 mM)、葡萄摄取速率(50-60 min)和糖酵解速率(85-170 min)方面观察个体化反应。葡萄糖曲线下面积(AUC)用于检测糖尿病和糖耐量受损,以及识别糖尿病风险增加的人群。微针传感器的AUC数据表明,该女性参与者患糖尿病的风险高于男性参与者。图5d显示了微针传感器对多事件活动的响应。葡萄糖的结果密切反映了所摄入的食物。植入微针传感器后第7天和第14天,小鼠皮肤切片中炎症细胞浸润密度没有明显增加,这表明葡萄糖传感器具有良好的生物相容性。
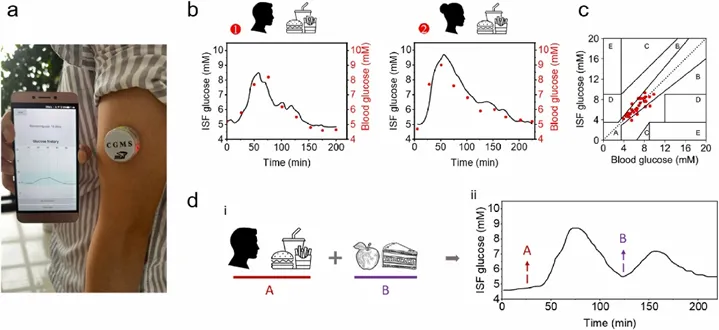
图5 差分微针传感器的体内性能
总结
作者展示了一种完全集成的可穿戴差分微针传感系统,以低成本的方式连续、无痛、实时测量ISF葡萄糖。葡萄糖数据由定制的电子设备捕获,无线传输到定制的移动应用程序,促进高级可视化和分析。在微针阵列中引入差分传感电极,显著提高了葡萄糖电极的抗干扰能力和检测精度。数值模拟分析了微针的穿皮机理,表明合理的设计提高了微针的穿皮效率,减小了微针的受力。最后,将该装置应用于人类参与者,并采用标准化参考方法进行平行测试验证。通过将检测点移动到皮肤下几微米,实现了无创、无痛的葡萄糖监测。


