点击左上角“锂电联盟会长”,即可关注!

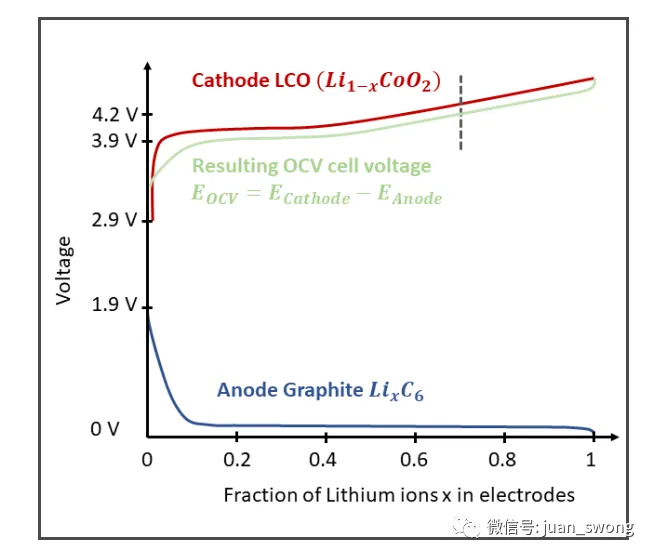
如果将灯连接到锂电池,电流就会流动,灯就会开始发光。但为什么会发生这种情况呢?为什么电池放电后电压会下降?这与锂离子的浓度有什么关系?为什么电极类型会影响电池的容量?本文提供了答案。锂基电池——无论是固态电池还是传统锂离子电池——在结构上基本相似。有两个电极(正极和负极),其间有隔膜。充电时,离子从正极(阴极)迁移到负极(阳极),放电时,离子再次迁移回来。由于隔膜对电子是不可渗透的,因此电子会穿过连接的负载(例如灯),并导致其点亮(特别是有关固态电池构造的更多信息,请参见此处)。该描述可以用来解释为什么电流在负载中流动,但不足以理解该能量从何而来。为此,有必要更深入地研究电池的功能。首先要明确为什么可以测量正负极之间的电压。锂基电池的电压窗口由负极和正极处的部分反应定义,并相应地取决于那里发生的反应。电池两极可测量的电压是各个电极产生的电压之差:负极和正极的电压不是固定值,而是取决于电池的充电状态。然而,文献中经常给出电极的固定值(例如,LCO 为 3.9 V,参见[1])。这些通常对应于平均电压。图1 显示了如何从负极和正极电势得出最终的电池电压(在示例电池 LCO | 石墨上显示)。x 轴显示电极中按比例结合的锂量。对于(理想)满电池 x=1,对于空电池 x=0。图1:LCO|石墨电池的电压分为负极电势和正极电势。通常,只有 70% 的锂离子从正极中提取(虚线)。材料选择对于固态电池来说并不典型,但原则上是可能的 。[2] 电池正负极端的可测电压是由锂与电极发生的化学反应所产生的。以下将以LCO(锂钴氧化物)正极为例对此进行更详细的解释。图2展示了LCO|石墨电池的放电过程。这是一种带有液态电解质的锂离子电池。原则上,这种设计也适用于固态电池,尽管LCO和纯石墨作为电极材料是非典型的,而是使用了进一步发展的材料(例如硅石墨作为负极和NMC811作为正极)。电压由负极和正极的锂离子充放电过程产生。图中所示反应也适用于固态电池,但此处选择的材料并不典型,仅供参考。放电过程中,锂离子从负极迁移到正极。LCO 是一种具有层状结构的正极。放电过程中,锂在氧化钴层之间插层。锂与氧化钴的反应方程式如下:CoO2 + e– + Li+ → LiCoO2 [3]外部可测量电压的产生是由于锂在层状氧化物各层中的插层反应以及在这一放热过程中释放的能量。借助所谓的 Nernst 方程,可以根据电池中的物质浓度计算出半电池的电压:Ured = U(0,red) – (RT / (ze F)) * ln(αRed / αOx)U0,red: 电极电位(可从电化学电压系列表中读取)
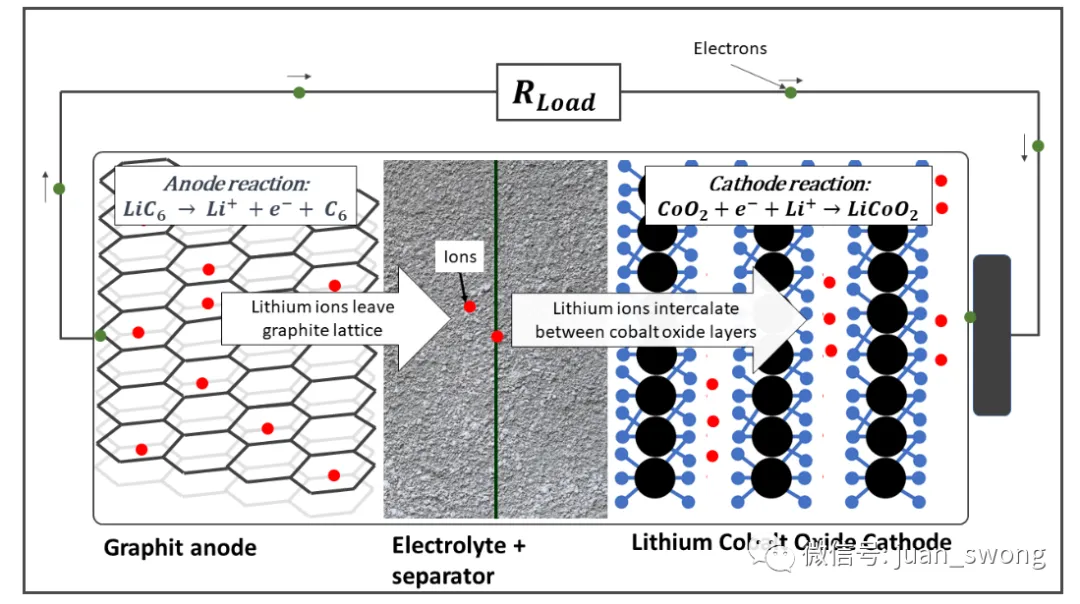
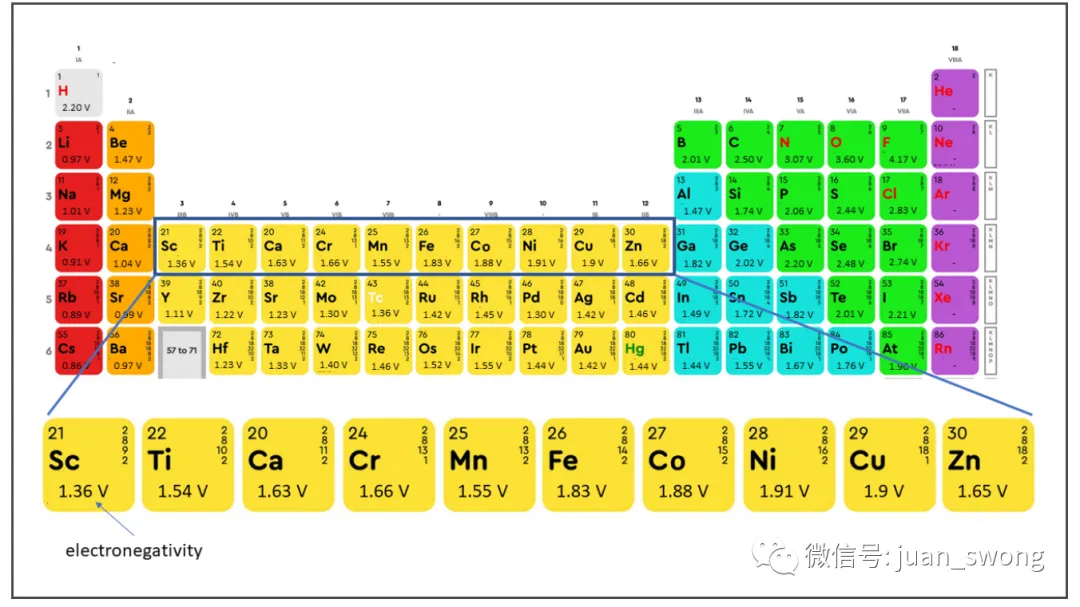
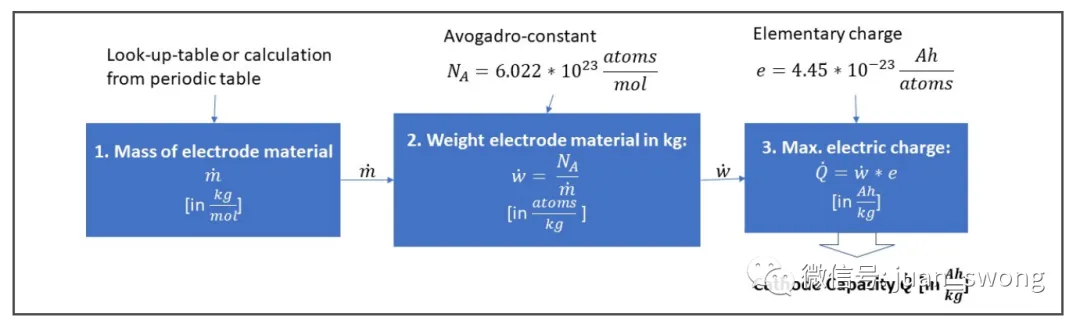
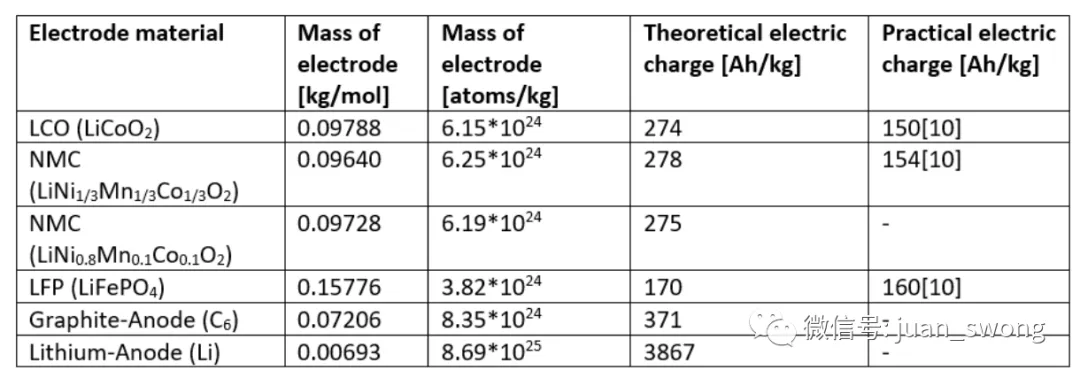
ze: 转移电子数:转移电子数(锂只有一个价电子,因此此处为 1)氧化还原反应物的浓度随电极电荷状态的变化而变化。因此,产生的电极电压基本上取决于电极电位,电极电位根据温度和电荷状态进行校正。应该指出的是,一些二次反应也发生在电池中,这也影响到所产生的电压,因此上述方程只能作为第一近似值使用。由于能斯特方程对电极电位的强烈依赖性,我们尝试在这里选择具有最高电极电位的元素(参见图3)。元素周期表右边的元素在这里达到了更高的比例,因为元素的离子半径减小了,电子更强烈地被原子核吸引。更强的核作用力会导致更高的电极电位。这种联系也解释了为什么 LCO (LixCoO2)和 NMC811被用作正极材料。在过渡金属中,这些是半电池电压最高的化合物(见图3)[4]。电池的可允许电压范围不仅受电极的影响,还受所使用电解质的电化学窗口限制。特别是液态电解质不能承受超过4.5V的电压,因为正极与电解质之间会发生寄生反应,导致电解质缓慢分解[5]。固态电池在中期内可能能够突破这种限制。例如,氧化物电解质具有特别宽的电压窗口,硫化物电解质在添加附加保护层后也可能能够承受更高的电压[6]。电压窗口的第二个重要限制是通常不能利用电池的完整物理电压窗口。对于LCO正极来说,将锂从钴层中溶解超过70%是不可能的,因为这会削弱正极的机械结构,导致加速老化。因此,与Li/Li+相比,LCO电池的电压被限制在4.2V[7]。在负极方面,通常也不能将所有锂离子移除,因此一些锂离子仍然留在负极,从而降低了最大可实现的容量。为了使电池提供最大容量,负极和正极必须被调整得当,以便在充电过程中,所有从正极出来的锂离子都能在负极结构中找到储存的位置。负极尺寸与正极尺寸之间的比例称为N/P比,其中N描述负极的质量分数,P描述正极的质量分数。由于每个从正极出来的锂离子都必须在负极找到一个位置,所以尺寸比N/P≈1。然而,锂离子很难总是在负极找到一个位置。在快速充电过程中,锂离子往往倾向于在负极上沉积(锂电镀),因为它们不能迅速在负极结构中找到空闲位置[8]。由于锂电镀是电池的主要损坏机制之一,负极的比例稍微增加(N/P≈1.04-1.2)[9],以使离子不必寻找太长时间才能找到空闲位置。各种活性材料的容量通常以Ah/kg为单位给出,并可以通过计算(见图4中的计算方案)得出。计算只考虑活性材料。在电极理论容量的计算中忽略了化学助剂、接触表面、保护层等。计算时,首先确定电极材料的质量(以kg/mol为单位)。这个值可以通过摩尔质量计算或者从查找表中获取。对于LCO,摩尔质量为0.09788 kg/mol。在第二步中,可以利用阿伏伽德罗常数计算一千克电极材料中有多少分子(对于LCO,这是6.15*10^24个原子每千克)。作为碱金属(第一主族的元素),锂只有一个可以参与化学反应的电子。每个电子带有一个负的基本电荷 e–。因此,一个锂原子可以释放一个基本电荷 e–。为了计算容量,现在必须考虑到在放电过程中,每个锂离子都会通过连接的负载传递一个电子。因此,容量是一个原子所携带电荷量与原子数量的乘积。对于LCO,这导致容量为274 Ah/kg。其他正极材料和负极材料的容量也可以用同样的方法计算。图5列出了最重要的正极材料的计算理论能量密度。计算值代表理论上可实现的能量密度,但通常与实际值不太接近。例如,对于LCO,在充电过程中只能去除部分锂,因此理论容量没有得到充分利用,并且在实践中获得的值明显较低。尽管如此,计算得出的数据为比较不同的活性材料提供了一个很好的指标。锂电池的能量实际上从何而来的问题的答案很清楚:原因是充电和放电过程中电池中或多或少可逆地发生的氧化还原反应。由于电池的结构,充电期间电子被迫通过充电器迁移到负极。由此产生的电荷转移导致锂离子也迁移到负极。放电时,过程相反,电流流过连接的负载并传输功率。电池在给定充电状态下产生的电压可以使用能斯特方程计算,并且主要取决于电极上锂离子的浓度。迁移到正极侧的锂离子越多,它们在正极的浓度就越高,电池电压相应下降。电池能提供多少能量取决于电池的容量。容量是特定于材料的变量,可以使用简单的方程直接从材料数据计算出来。所有计算出的参数均代表理论(最大)值,在实践中并未达到。电压受到电解液的限制,容量的充分利用会影响正极的机械稳定性。此外,为了防止锂的寄生沉积,所使用的负极材料总是比绝对必要的材料稍多一些。良好设计过程的目标是权衡所有这些影响,以获得能够在汽车使用中耐受数百次循环的实用电池。最好的电池始终是妥协的结果。[1] Park, J: Principles and Applications of Lithium Secondary Batteries, Department of Chemical & Biomolecular Eng., Korea, 2012, S. 28[2] Qnovo: The science behind why the battery vendors are hitting the wall, 2014, https://www.qnovo.com/blogs/why-battery-vendors-are-hitting-the-wall[3] J. Goodenough, K. Park: „The Li-Ion Rechargeable Battery: A Perspective“, American Chemical Society, 2013[4] Liu, C., et al.: “Understanding electrochemical potentials of cathode materials in rechargeable batteries”, Materials today, 2016[5] Yang, L.; Ravdel, B. ;Lucht, B.: „Electrolyte Reactions with the Surface of High Voltage LiNi0.5Mn1.5O4 Cathodes for Lithium-Ion Batteries“, Electrochemical and Solid-State Letters, 2010[6] Fraunhofer Institute for Systems and Innovation Research ISI: Solid-State Battery Roadmap 2035+, Karlsruhe, 2022[7] Korthauer, Reiner : Handbuch Lithium-Ionen-Batterien, Frankfurt, 2013[8] TYCORUN: A comprehensive guide to battery cathode and anode capacity design, 2022, https://www.tycorun.com/blogs/news/a-comprehensive-guide-to-battery-cathode-and-anode-capacity-design[9] TYCORUN: Design anode to cathode ratio of lithium-ion battery, 2023, https://www.takomabattery.com/anode-to-cathode-ratio/[10]: Park, J: Principles and Applications of Lithium Secondary Batteries, Department of Chemical & Biomolecular Eng., Korea, 2012, S. 28
相关阅读:
锂离子电池制备材料/压力测试!
锂电池自放电测量方法:静态与动态测量法!
软包电池关键工艺问题!
一文搞懂锂离子电池K值!
工艺,研发,机理和专利!软包电池方向重磅汇总资料分享!
揭秘宁德时代CATL超级工厂!
搞懂锂电池阻抗谱(EIS)不容易,这篇综述值得一看!
锂离子电池生产中各种问题汇编!
锂电池循环寿命研究汇总(附60份精品资料免费下载)