近年来,类器官(Organoids)和器官芯片(Organs-on-Chips,OoCs)作为两种新兴的三维细胞培养技术,得到迅速发展,以弥补体外二维培养和动物模型之间的差距,从而推动临床相关的药物发现和人类疾病建模。尽管这两者共享相似的目标,但其方法和实施要求却各不相同。
据麦姆斯咨询报道,近期,来自多伦多大学(University of Toronto)的研究人员在Nature Reviews Bioengineering期刊上发表了一篇题为“Integrating organoids and organ-on-a-chip devices”的综述性论文,首先定义了类器官和器官芯片,强调它们的物理尺度,并讨论它们与组织工程和再生医学领域中开创的技术和概念的关系。然后,重点阐述了目前研究的目标,特别是希望创建一个具有体内样细胞保真度、流动控制、生物物理刺激和传感器集成的优越培养系统。最后,提供了对新进入从业人员的建议以及对经验丰富的研究人员的建议,以推动这一领域向更好的可转化性发展。类器官(organoids)和器官芯片(OoCs)文章首先详细介绍了类器官和器官芯片作为先进的3D细胞培养技术在药物开发、疾病建模以及组织工程和再生医学中的应用和发展历程。类器官是一种自组织结构,通常由人类多能或成体干细胞扩展、分化和形态生成而来。其包含多种细胞类型和与特定器官区域相似的细胞结构和功能特征,在形态生成和复杂的多细胞组织结构方面具有优势,但缺乏与其他器官和组织区隔的系统性互动,常常没有可灌注的血管和免疫系统。为克服某些限制,研究人员已经开发了组合体(assembloids),希望通过融合不同类型的类器官形成自组织细胞系统。
器官芯片支持细胞组装成类似组织结构的工程化或微加工培养系统,可测量模拟器官的功能特征。虽然不完全再现整个器官,但器官芯片系统能够提供更精确的3D细胞培养,以模拟一个或多个组织的生理反应。器官芯片平台具有多个共同特征,包括整合多种细胞类型,使用膜或柱阵列促进营养物质和氧气的运输,以及通过组织固定来控制几何形状和多轴拉伸。此外,器官芯片系统可能在单一设备中结合多个组织,提供对器官级互动和生理的洞察,但这些系统并不总能完全捕捉治疗的系统性反应,且实现起来成本高且需要专业技术。
类器官、组合体和器官芯片是模拟目标组织生物过程的先进3D细胞培养技术,但仍然缺乏适当的血管化、药代动力学和药效学的常规评估、药物耐受机制的识别及非靶向效应。这些系统操作的尺度通常在几百微米到约1厘米之间,通常再现负责器官关键功能的组织成分。器官芯片和类器官是可用于组织工程和再生医学应用的体外方法。组织工程是细胞、生物材料支架和生物反应器的集成使用,以创建可以探测疾病病因、药物疗效和发育机制并替代或增强本体组织结构的组织。再生医学侧重于使用多能或成体人类干细胞、其后代和相关技术(如基因编辑)来替代、再生和功能性恢复因年龄、疾病、事故或先天缺陷损坏的组织和器官。
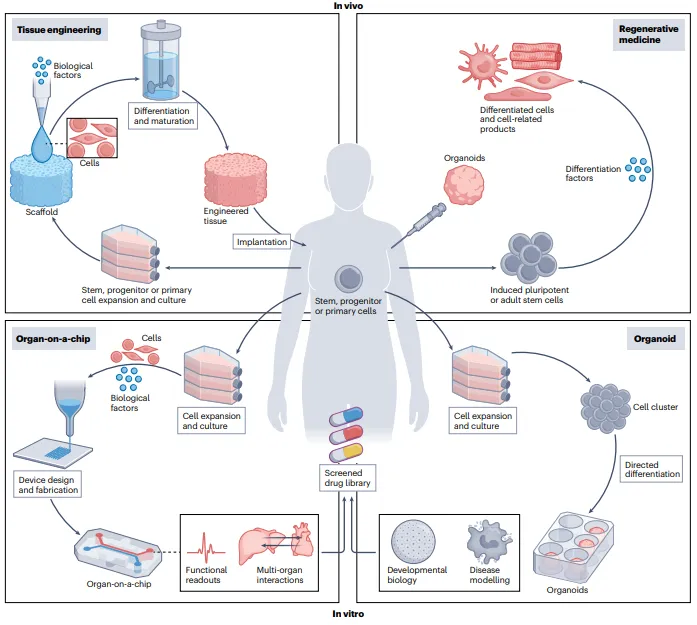
类器官和器官芯片系统中的主要方法
(1)整合的动机。整合类器官和器官芯片旨在结合两者的优势,克服各自的挑战。器官芯片的精确几何和微观特征有助于引导类器官发育,提高一致性和成熟度,并通过内置传感器实现现场功能读数。类器官提供复杂的细胞组成,增强器官芯片的功能。(2)整合的优势。结构支持和细胞一致性:器官芯片提供细胞结构支持,类器官在细胞保真度和结构相关性上更接近人类组织;流动控制和传感器整合:器官芯片能控制流动并结合多种传感器,培养可重复性高于类器官。培养可重复性:器官芯片培养的可重复性优于类器官,后者常因坏死核心形成和批次间变异性而受到限制。(3)整合的挑战。培养环境:类器官在器官芯片中的整合需要控制其生长,可能影响其特性和细胞谱系的确定。成像和药物分布:类器官更兼容药物研发管道,成像更容易,但难以捕捉药物在体内的分布和扩散。(4)输出和测量。类器官和器官芯片都适用于标准技术,如免疫荧光染色、“组学”分析和电场电位记录。器官芯片通过控制流动,提供更精确的功能测量。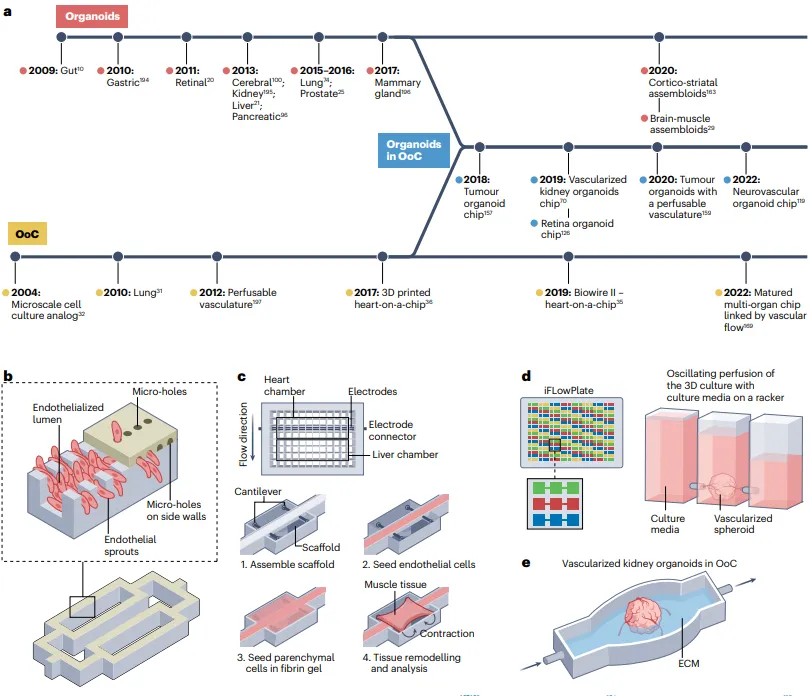
类器官与器官芯片集成的多孔板装置的发展时间线和示例
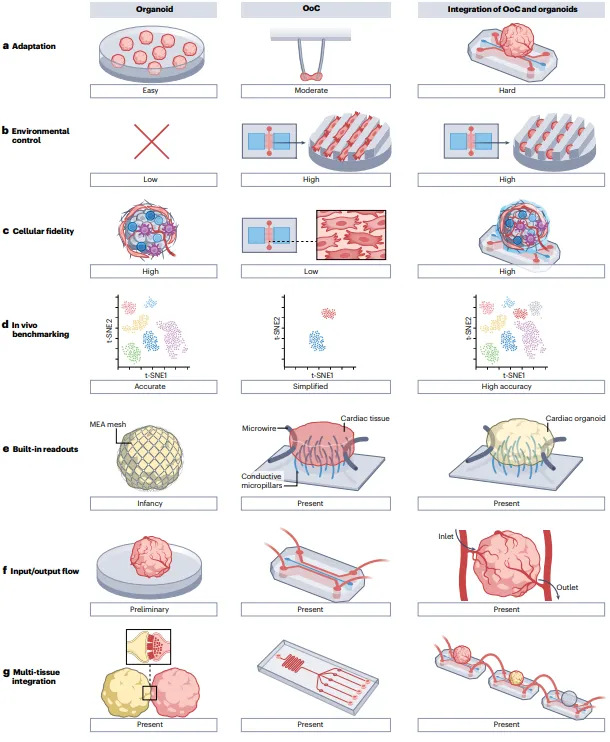
类器官与器官芯片系统集成的进展和挑战
该综述突出了在各种器官模型中整合器官样体与器官芯片系统的进展和挑战,强调了生理相关性和疾病建模能力方面的进展。整合器官样体和器官芯片系统能够实现更高的模型复杂性。这种整合相比单一方法具有优势,但选择取决于生物学问题。器官样体保留了组织结构,但缺乏血管化和蠕动运动,这些方面被器官芯片捕捉到。像iFlow板和PDMS膜器件这样的整合系统增强了生理相关性,模拟了免疫招募和蠕动运动。在复制完整器官生理学和整合额外细胞类型方面仍面临挑战。肠道器官样体模仿原生结构,但缺乏血管化和腔内访问。器官芯片装置改善了屏障功能研究,并模拟了蠕动运动,这对于模拟炎症和感染动态至关重要。肾脏器官样体复制肾单位结构,但缺乏成熟血管。具有灌流芯片的器官芯片增强了跨上皮运输和药物吸收,对疾病建模和药物测试至关重要。肺部器官样体发育出类似气道的结构,但需要长期培养以进行分支形态发生。肺芯片模型模拟肺泡-毛细血管相互作用,对研究呼吸系统疾病至关重要。肝芯片系统模拟代谢功能和疾病机制。器官样体整合增强了肝细胞功能和胆管形成,但在复制窦oidal内皮细胞功能和空间异质性方面面临挑战。胰腺芯片模型有助于研究囊性纤维化和糖尿病等胰腺疾病,实现胰岛素分泌和药物反应的功能评估。大脑器官样体和组装体模拟大脑发育和疾病机制,但缺乏血管化。大脑芯片设备模拟血脑屏障功能和神经活动,推动药物筛选和疾病建模。心脏器官样体和心脏芯片系统模拟心脏发育和疾病,但在完全复制心室方面存在困难。整合到器官芯片中的肿瘤器官样体增强了肿瘤侵袭研究和药物测试,但在复制复杂肿瘤微环境方面仍然面临挑战。多器官系统使用组合体和器官芯片方法形成。组合体如皮质-纹状体组合体用于研究染色体22q13.3缺失对钙活性的影响。最近,研究人员还尝试在微流控系统中结合脑-脊髓组合体以监测神经信号传输。组合体适合模拟身体内紧密相邻的组织,例如包含外层肌肉层和内层上皮层的膀胱组合体可增强组织成熟性。相比之下,器官芯片在模拟远距离器官的相互作用时更有用。例如,一个无泵多器官芯片系统可预测肝脏、肿瘤和心脏系统中的药物效力和代谢转化,同时在不同区域之间循环无血清介质。然而,要模拟真正的器官-器官相互作用,需要具备功能性血管系统进行通讯,这是器官芯片面临的最大挑战之一。此外,多器官系统中不同器官样体和组织所需分化培养基的差异也是一个重要障碍。血管化是类器官和器官芯片的重要挑战。氧气在组织中的扩散极限约为100微米,超过此值会导致营养和氧气供应不足,造成坏死。血管化对于类器官的旁分泌通信、机械刺激、组织成熟、内皮屏障功能和多类器官系统的通信至关重要。体外血管工程有两种主要方法:自组装和空腔通道制造。自组装方法将内皮细胞和支持细胞混合在水凝胶中,形成含管腔的血管网络,支持细胞通过分泌关键细胞因子促进这一过程。空腔通道制造方法则是在水凝胶或聚合物中制造空腔通道,然后进行内皮细胞播种。该方法难以控制直径,通常适用于较大血管。微流控装置可以帮助控制血流。天然水凝胶易于形成血管腔,但机械性能较弱,容易塌陷。合成聚合物强度高,但渗透性不足。AngioChip通过在聚合物上压制微孔,实现了血管和实质性区域的通信。血管化类器官面临的主要障碍是培养基不匹配,类器官和支持血管形成的培养基不同。尽管血管化类器官有潜力,但实现这一目标仍面临许多技术挑战。实施集成方法的难度取决于研究人员的技能。熟悉类器官的研究人员可以使用现成的开放式器官芯片系统,而熟悉器官芯片的研究人员可以使用商业化的类器官分化套件。初学者应先分别使用每种方法的商业系统,再尝试集成。集成方法需要开发控制类器官形状和大小的生物材料,并解决类器官分化阶段放入器官芯片设备的挑战。应用物理刺激(如电、机械、流动等)可提高系统的生理复杂度。血管化是所有领域的挑战,目标是创建稳定、可寻址和可灌注的血管网络。将不同输入和输出连接到正确细胞类型也是一大挑战。更复杂的模型更难应用于工业实践,需要整合到自动化细胞培养和表征工作流程中,以提高一致性、可重复性和效率。处理流量也变得更加重要,开放式微流控配置具有更大的可扩展性。在类器官和器官芯片中提取数据是其相比动物模型的基本优势。当前努力应集中在信息提取上,即可扩展的分析。细胞系和批次间的差异性问题需要解决。报告细胞的性别并设计具有不同性别特征的实验有助于捕捉性别特异性药物反应和疾病表现。最后,需要定义通用的验证和基准标准,以与体内器官进行比较。类器官和器官芯片的快速发展旨在提供更相关的人类模型,集成方法可以捕捉单一方法无法实现的现象。未来需要克服细胞系的差异性和血管化问题,规模化设备生产和人工智能分析方法是必要的,定义适当的验证标准有助于更广泛的应用。论文链接:
https://doi.org/10.1038/s44222-024-00207-z
延伸阅读:
《即时诊断应用的生物传感器技术及市场-2022版》





