最近,表面增强拉曼散射(SERS)通过增强等离激元纳米结构上分子的拉曼信号,实现了生物分子的高灵敏度、无标记识别和定量检测。基于表面增强拉曼散射的微针传感器已被开发用于检测多种分析物。虽然通过修饰微针表面金属材料进行原位SERS分析很简单,但这种皮下注射可能会导致毒性或样品污染。因此,等离子体微针传感器的这些局限性仍需要进一步改进。
为解决上述挑战,近期,来自深圳大学的研究人员设计了一种基于微流控的可穿戴等离子体微针传感器,用于间质液(ISF)采样和微创尿酸监测。在手指推动产生负压的作用下,空心微针阵列可以通过微流控通道提取皮下液体并将其输送到传感室进行SERS检测。基于三维(3D)金纳米阵列的SERS传感芯片被发现具有出色的重现性,RSD为5.96%。这种高密度微针阵列可对尿酸分子进行超灵敏且无标记的检测,检测限为0.51 µM,并可通过与手持式拉曼光谱仪集成来快速识别目标分子。该传感平台有望为日常生活中的高效医疗保健和早期疾病预防带来无限可能。相关研究以“Microfluidic-based plasmonic microneedle biosensor for uric acid ultrasensitive monitoring”为题发表在Sensors and Actuators B: Chemical期刊上。
可穿戴等离子体微针传感器的设计
如图1a所示,可穿戴等离子体微针传感器主要由微针阵列、微流控芯片、SERS基板和吸盘组成。吸盘充当触摸开关,用手指产生足够的压力,以方便微针插入皮肤。一旦手指被释放,负压就会将间质液提取到微通道中并将其输送到SERS传感芯片。吸盘和空心微针之间的SERS传感芯片通过微流控通道连接,用于尿酸分析。SERS传感芯片主要由硅晶圆上的纳米金阵列组成。化学和环境稳定的纳米金作为等离子体天线,可以增强SERS信号,是可穿戴等离子体应用的理想选择。电磁场通常出现在纳米结构的纳米间隙和尖锐尖端,通常称为“热点”。如图1d所示,SERS基底可以通过天然指纹振动信息直接识别和定量尿酸。纳米金阵列产生的热点可以显著放大尿酸分子的拉曼散射信号,从而实现无标记检测。
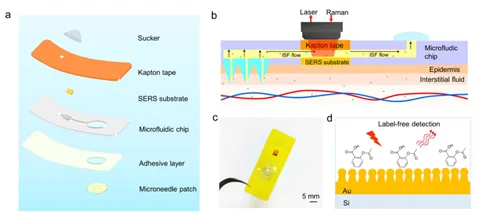 图1 可穿戴等离子体微针传感器的示意图和图像
图1 可穿戴等离子体微针传感器的示意图和图像
可穿戴等离子体微针传感器的表征
图2a和2b显示微针贴片主要由呈现均匀分布的4 × 4圆锥形阵列组成。图2c中贴片的外径约为5 mm。微针贴片的厚度约为300 μm,两个相邻微针尖端之间的距离约为900 μm。每个圆锥形微针的高度约为700 µm,从底部到尖端有一个贯穿微通道(直径为150 µm)。通过有限元分析(FEA)模拟针尖状界面插入皮肤后所经历的应力分布,以确定最大应力的位置(图2d)。结果表明,应力集中发生在微针尖端。通过施加600 g的力2分钟来评估微针贴片在石蜡膜上的穿透性能。微针贴片具有穿透10-20 μm人体角质层的潜力。微针贴片的采样能力主要受亲水性和驱动力的影响。因此,用空气等离子体处理微针贴片以产生亲水表面。R6G在大约26秒时首次出现在微针背面的滤纸上。当所有微针通道都充满R6G溶液时,提取时间约为136 s。结果表明,亲水性微针贴片具有极好的快速芯吸液体的能力。
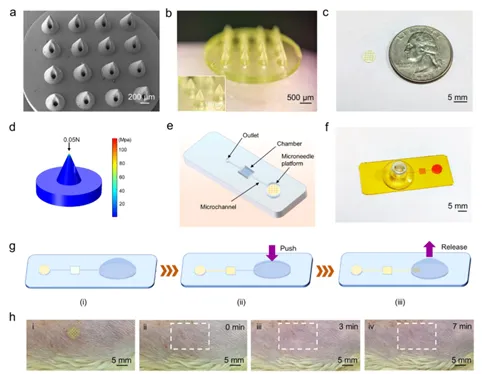
图2 可穿戴等离子体微针传感贴片的特性
虽然微针可以通过毛细力提取液体,但这种毛细力无法将其快速输送到传感区域。因此,研究人员进一步设计了带有吸盘的微流控芯片,以有效地输送间质液(图2e和2f)。传感室可支持1.8 µL的体积。手动启动的吸盘可以充当压力泵,通过负压机制将流体输送到微流控通道中。如图2g所示,多次手动按压和释放吸盘(放置在出口处)导致流体从微针区域排出,并沿着微流控通道直接到达传感室。多余的液体通过出口排出。值得注意的是,排出的液体并不总是最初要输送的液体。此外,微流控芯片还可以通过结合微针在猪皮肤中提取和输送皮下液体。为了评估皮肤生物相容性,将微针贴片贴在小鼠皮肤上,去除后7分钟内皮肤上的穿刺痕迹逐渐消失(图2h)。结果表明微针贴片具有微创特性。
可穿戴等离子体微针传感器检测尿酸的性能
Au-SERS基底是通过在硅纳米阵列上沉积纳米金来制造的。图3a显示了硅晶片上具有典型球形轮廓的纳米金阵列的俯视形态。有序排列的球形纳米金的尺寸约为120 nm。使用能量色散光谱(EDS)图来确定金沉积在硅纳米阵列上的可能性。结果表明SERS基底是干净的并且没有其他杂质。为了确认SERS基底的亲水性,测量了接触角。SERS基底的水接触角确定为55°。Au-SERS基底的消光光谱是通过UV/Vis-NIR分光光度计进行的。使用有限元分析(FEA)商业包来模拟不同激发波长(532 nm、633 nm和785 nm)下的电场分布。两个球形纳米金之间的间隙中电场相对较强。并且785 nm处场强相对较高。
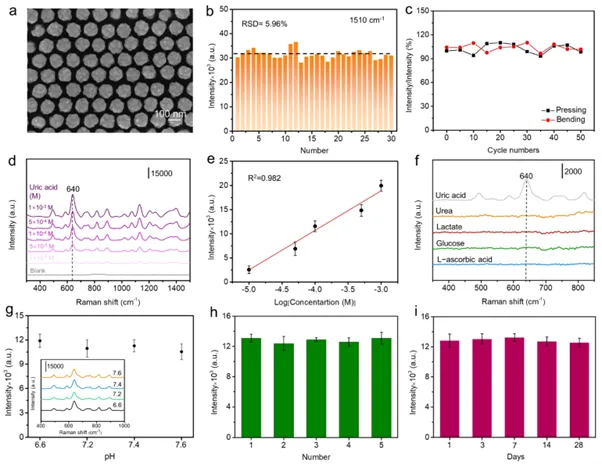 图3 可穿戴等离子体微针传感器的尿酸检测性能
图3 可穿戴等离子体微针传感器的尿酸检测性能
此外,该研究评估了SERS基底的均匀性。图3b显示了30个随机位点的1 ×10⁻⁶ R6G(1510 cm⁻¹)的SERS强度。所有SERS活性位点均表现出相对一致的拉曼强度。1510 cm⁻¹处强度的相对标准偏差(RSD)低至5.69%。传感器中的SERS基底在不同的机械力(弯曲和挤压)下保持相对稳定的SERS性能,如图3c所示。3d中展示了传感器获得了尿酸标准溶液的浓度依赖性SERS光谱。640 cm⁻¹处的峰是最显著的变化,可以被认为是定量分析尿酸的特征峰。640 cm⁻¹处的尿酸特征峰归属于环变形振动。图3e显示了SERS强度和尿酸浓度之间的线性校准图。SERS强度随着尿酸浓度的增加而增加,表明SERS底物可以有效监测尿酸的变化。当信噪比(S/N)为3时,检测限(LOD)为0.51 µM。如图3f所示,在640 cm⁻¹处没有观察到其他生物标志物(包括100 µM/L抗坏血酸、葡萄糖、乳酸和尿素)的明显SERS响应。结果表明特征峰强度不受其他干扰物的影响。图3g显示了1 × 10⁻⁴ M尿酸(640cm⁻¹)在pH 6.6-7.6范围内的SERS光谱和强度。结果表明,该传感器在尿酸监测方面保持了良好的稳定性。此外,五个传感器的1 × 10⁻⁴ M 尿酸(640 cm⁻¹)的SERS强度如图3h所示。结果表明,该传感器具有良好的重现性。如图3i所示,传感器在28天内表现出良好的稳定性。
可穿戴等离子体微针传感器的评估
为了满足便携式、快速检测的需求,采用手持式拉曼光谱仪实现样品SERS光谱的采集、处理和分析。如图4a所示,便携式手持式拉曼光谱仪主要由电荷耦合器件(CCD)、激光器、光谱仪、探测器和微处理器系统组成。它集成了功能单元,包括测量、分析和反馈(图4b)。研究人员验证了可穿戴等离子体微针传感器与商业比色测定试剂盒在分析样品时的准确性,并获得了0.998的高Pearson相关系数。结果表明了可穿戴等离子体微针传感器的测量可靠性。为了进一步研究体内检测尿酸的可能性,研究人员使用猪尸体皮肤来模拟人体皮肤。如图4e所示,与对照相比,实验组传感器表现出明显的源自尿酸的SERS响应(在640 cm⁻¹处),表明尿酸检测成功。图4d显示了对照和实验之间测量的尿酸水平的比较。结果表明,实验中的尿酸丰度(p < 0.001)显著高于对照。健康成人血清中尿酸的生理范围在90-420 µM 之间,浓度高于上限则被认为是高尿酸血症或痛风。采用不同浓度的尿酸来模拟不同疾病状态的监测阈值(i:健康样本加标100 µM;ii:高尿酸血症样本加标450 µM;iii:痛风样本加标600 µM)。图4f显示了传感器在不同疾病模型中从皮肤获得的尿酸水平。与健康样本相比,异常样本的尿酸浓度存在明显差异。研究结果表明,该传感器可以识别健康样本和异常样本中的尿酸水平,并可能作为疾病诊断的早期筛查平台提供疾病预警。
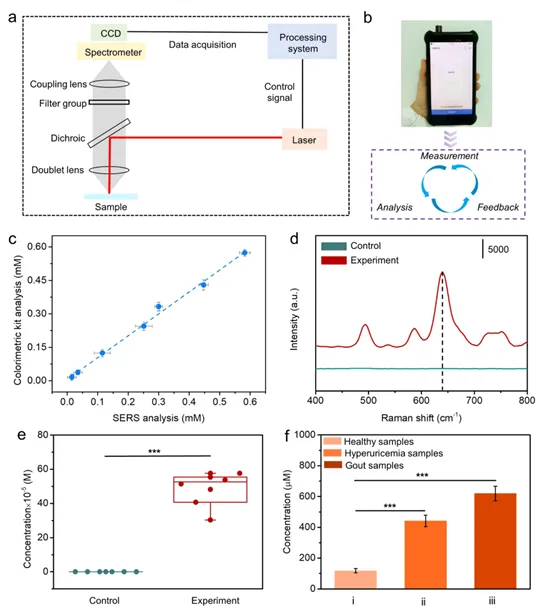
图4 可穿戴等离子体微针传感器的评估

