微流控芯片中血管网络的构建对于三维(3D)细胞聚集体(如球体、类器官、类肿瘤或组织外植体)的长期培养至关重要。然而,尽管微血管网络系统和类器官技术发展迅速,但芯片上类器官的血管化仍然是组织工程中的一个挑战。大多数现有的微流控装置不能很好地反映体内流动的复杂性,并且需要复杂的技术设置。
为解决上述挑战,近期,来自加拿大英属哥伦比亚大学(University of British Columbia)的研究人员开发了一种微流控平台来建立和监测间充质和胰岛球体周围内皮网络,并成功构建了基于多能干细胞的血管化类器官,相关研究成果以“A microfluidic platform integrating functional vascularized organoids-on-chip”为题发表在Nature Communications期刊上。
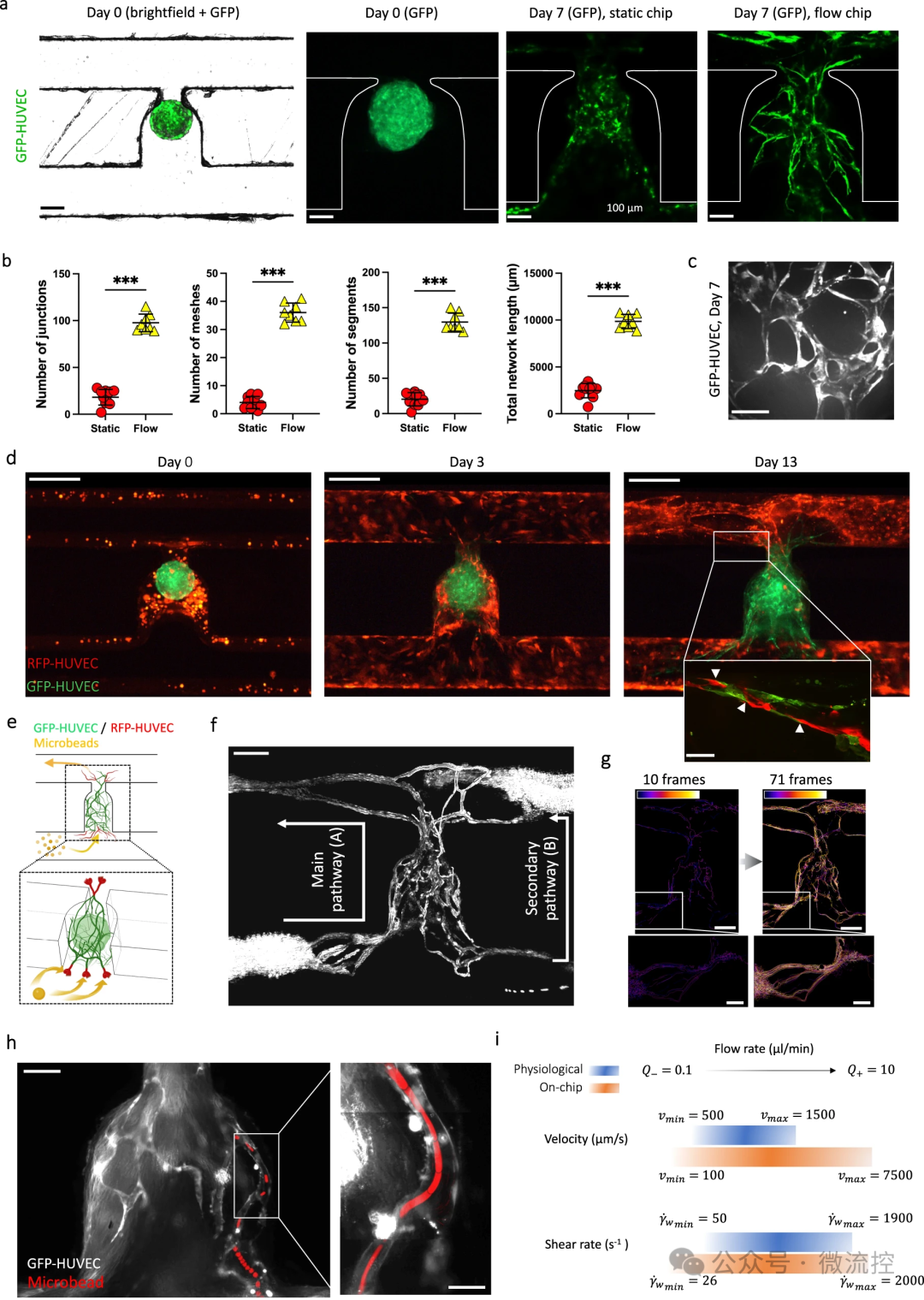
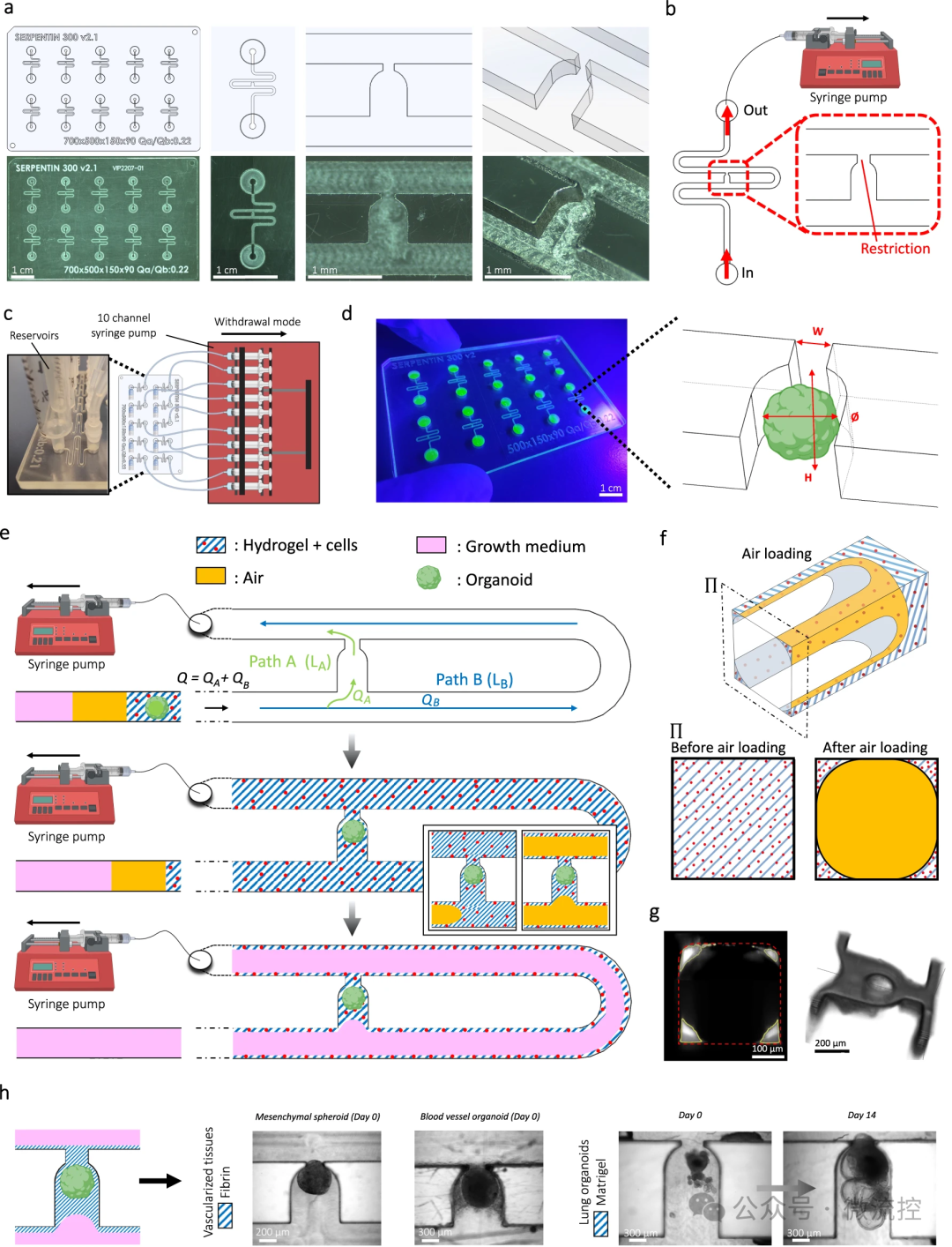
该微流控平台采用流体动力学和毛细管效应进行包封过程,从而简化了3D细胞聚集体的血管化。这种方法上的创新使得类器官能够在微流控芯片上培养长达30天,证明了该平台在支持长期实验方面的实用性。该研究概述了优化包封过程所涉及的技术考虑因素,包括调整凝胶层厚度和减少包封过程中细胞损失的策略。此外,该微流控平台采用环烯烃共聚物(COC)制备微流控芯片,因为其具有自身荧光性低、耐化学性强和药物吸收率低的特性。同时,研究人员使用高精度铣削设备将微流控图案直接加工到COC片上。其次,在大多数研究中,流量由静水压力决定,这是一种简单且经济高效的液体驱动原理。然而,最佳的静水压差无法长期维持,因此必须定期更换培养基。通过使用摇杆灌注平台可以避免这种情况,因为生理相关的流体动力学(即压力调节和/或蠕动)会减少。在该研究中,研究人员通过使用注射泵克服了这个问题。通过使用20 mL注射器,微流控灌注可以以1 μL/min的流速维持两周,而无需断开注射器。此外,通过使用10通道注射泵,可以轻松并行监测10个不同通道中的流速。此外,研究人员将类器官和水凝胶放入流体动力学捕获区域中,使得细胞受到最小的剪切应力。这些捕获区域可以串联放置,从而容纳通过内皮网络互连的多个血管化类器官(包括不同的组织类器官)。
总体而言,该研究的定量数据不仅证明了该微流控平台在创建更多生理相关组织模型方面的潜力,而且还强调了其在生物医学研究各个领域的适用性。这种在微流控芯片上有效血管化类器官的能力为研究疾病机制、测试药物和探索再生医学策略提供了新的手段。
https://doi.org/10.1038/s41467-024-45710-4《即时诊断应用的生物传感器技术及市场-2022版》