隐球菌(CRY)是一类重要的致病真菌,已在全球70多个国家引起疾病爆发。然而,快速准确地检测隐球菌面临三大问题:(1)隐球菌表面有很厚的多糖荚膜,核酸提取困难;(2)隐球菌有两种主要的亚型,很难快速区分;(3)隐球菌核酸提取与检测步骤繁琐,且易于感染人体与污染环境。传统的病原体核酸提取与检测方法通常需要扩增(如PCR)的步骤,且需要训练有素的技术人员和昂贵的实验室设备,给在一些偏远的地方诊断隐球菌病带来了巨大障碍。因此,迫切需要一种创新的集成式芯片来实现快速和高灵敏度地检测隐球菌样本,以降低临床诊断隐球菌病的成本。
据麦姆斯咨询报道,针对这一需求,近期,北京航空航天大学/安徽医科大学常凌乾联合团队在Biosensors & Bioelectronics(IF = 12.7)期刊上发表题为“Rapid Cryptococcuselectroporated-lysis and sensitive detection on a miniaturized platform”的研究文章,提出了一种微流控生物芯片。该芯片集样本制备和结果定量于一体,实现了“样本进,结果出”的目的。此外,该芯片可以在20分钟内检测出隐球菌,并在1小时内达到最大检测限,且能够有效地区分隐球菌的两种亚型。
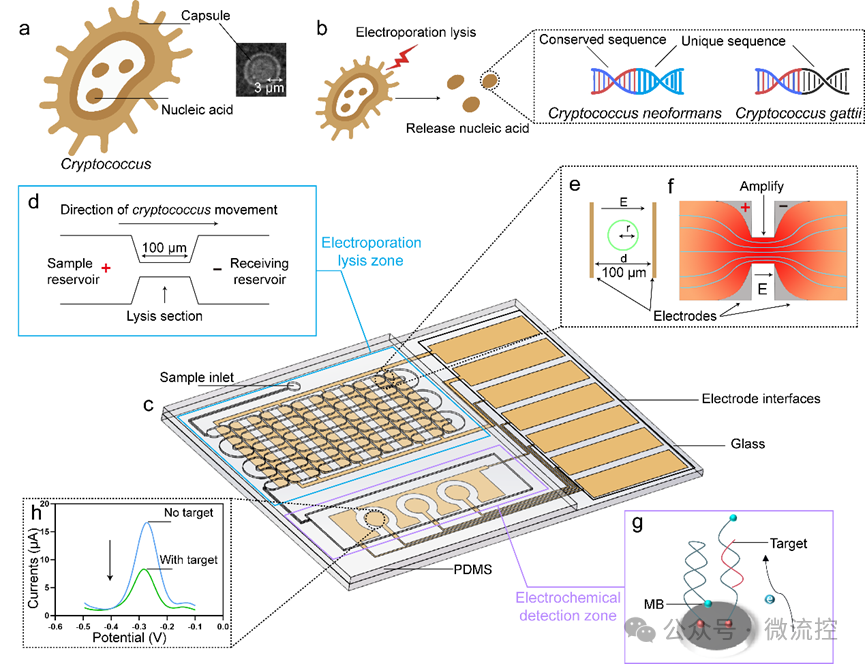
与其他真菌相比,隐球菌的特征是细胞体周围有一个荚膜(图1a)。隐球菌主要具有两种亚型:新生隐球菌(NEO)和格特隐球菌(GAT),研究人员可以通过它们各自独有的DNA序列进行特异性检测(图1b)。
为了实现快速、准确检测和区分隐球菌亚型的目标,研究团队设计了一种集成式微流控生物芯片。该芯片包含两个区域:用于细胞破裂的电穿孔裂解(EL)区域和用于核酸检测的电化学检测(ED)区域(图1c),二者通过蛇形微通道连接。EL区由两个电极组成,每个电极设计有六个矩形区域,彼此之间的距离为100 μm(图1d ~ 1f)。在EL区,通过微通道的收缩设计,可以将电场强度集中在收缩区域,实现了电场强度的显著放大,通过注射泵的驱动,液体样本中的隐球菌的荚膜在流经EL区时被快速的电穿孔裂解并释放核酸(图1c)。
随后,溶液会填充满整个ED区(图1c)。研究团队在三电极系统的基础上,在ED区设计了三个独立的电化学检测单元,包括三个工作电极、一个公共参比电极和一个公共对电极(图1c)。金纳米颗粒(AuNPs)可以与还原氧化石墨烯(rGO)上的氨基(-NH₂)非共价结合,从而可以在工作电极上进行修饰。特异探针通过金-巯基(Au-S)相互作用共价连接到AuNPs层,并在其5'端修饰了亚甲基蓝(MB)分子(图1g)。液体样本中的目标序列与工作电极上修饰的特异探针杂交后,MB分子从电极表面移开,导致电流减小,可以实现对目标序列的定量检测(图1h)。
接着,研究团队通过微分脉冲伏安法(DPV)研究了修饰电极的性能。DPV测试结果表明,NEO和GAT的检测限分别为60 pg/mL和100 pg/mL。
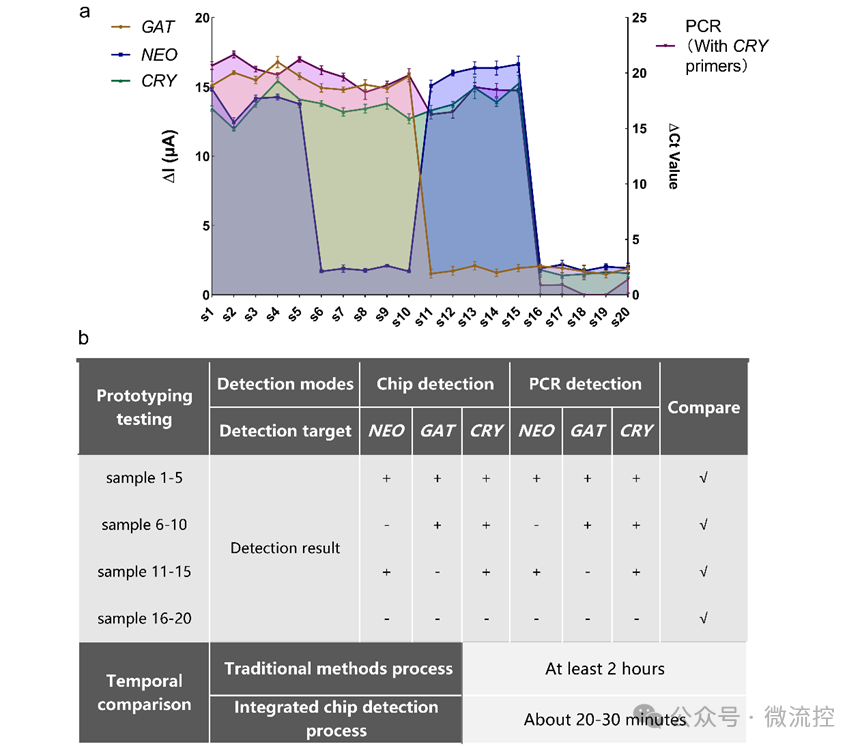
在临床应用中,研究人员对北京世纪坛医院提供的20个随机样本进行隐球菌的检测。将20个样本分为两组,其中一组样本通过该研究设计的微流控芯片进行裂解检测,另一组样本用传统的实验室方法进行裂解以及扩增检测(图2a)。结果表明,该检测平台在较短的时间内获得了与传统方法相同的检测结果,且操作简单,灵敏度达到了100%(图2b),这进一步证明了该微流控芯片平台在隐球菌检测中有着极好的灵敏度和实用性,具有良好的发展前景。此外,整个过程在封闭的环境中进行,避免了对周围环境和操作人员的污染,减轻了人员、时间和地点的负担。
综上所述,该微流控芯片结合了高灵敏、快速的电化学检测、快速的隐球菌电穿孔裂解、核酸提取等技术,集样本制备和结果定量于一体,实现了“样本进,结果出”的目的,这对于资源有限地区的隐球菌病快速、安全的医学诊断来说具有广阔的应用前景。
该研究的通讯作者为北航生物与医学工程学院常凌乾教授,医学科学与工程学院王杨副教授、董再再助理教授和安徽医科大学生物医学工程学院钱海生教授。第一作者为安徽医科大学生物医学工程学院的硕士研究生孔祥珠、程龙。安徽医科大学生物医学工程学院为第一作者单位。


