★
欢迎星标 果壳硬科技
★
氨是合成氮肥以及几乎所有重要含氮化学品的氮源。因此氮气还原为氨是维持地球上生命延续、满足人类对能源与化工需求的关键化学反应。Haber-Bosch合成氨过程被认为是20世纪最伟大的发明之一。然而虽历经了一个多世纪的发展,人工合成氨仍然需要在高温高压的苛刻反应条件(> 400℃,> 100 bar)下进行。鉴于全球日益严峻的能源和环境问题,发展可再生能源驱动的、温和条件下实施的新型固氮及合成氨新技术,是研究人员长期以来不懈追求的目标,也是化学科学中极具挑战性的研究课题。
近日,中国科学院大连化学物理研究所陈萍、郭建平研究团队在“氢化物化学固氮”研究方面取得新进展,揭示了氢化锂(LiH)光致脱氢变色现象与固氮之间的关联,并由此构筑了LiH介导的光催化合成氨过程。陈萍团队自2009年起致力于氢化物固氮化学研究,先后发展了过渡金属-氢化物催化合成氨(Nature Chemistry, 2017, 9, 64),氢化物介导化学链合成氨(Nature Energy, 2018, 3, 1067),以及配位氢化物催化合成氨(Nature Catalysis, 2021, 4, 959);在研究过程中我们注意到许多金属氢化物属于半导体,具有一定的吸光能力,而光和氢化物之间相互作用可能有助于介导某些小分子(如H2和N2)的化学转化,这是本论文的研究出发点。
氢化锂的光解
LiH的带隙大约为3.68 eV,可以吸收波长在350 nm以下的紫外光(UV)。实验发现,短暂的UV光照即可使LiH样品发生明显的变色现象,同时伴随着氢气的释放(图1a)。固体漫反射紫外-可见光谱表征结果显示LiH在UV照射下出现了一个以650 nm为中心的吸光带(图1b)以及尖锐而对称的顺磁共振波谱(EPR)信号(图1c)。这说明LiH在光照脱氢后,其表面可能生成了氢空位结构(F心)。我们进一步计算了具有两个氢空位的LiH(100)晶面的态密度(Density of states, DOS,图1d),发现电子更倾向于分布在氢空位中形成表面F心(图1e中黄色负电荷分布区域),从而在导带和价带之间形成了主要由Li的2p轨道组成的缺陷态。这一缺陷态的产生解释了LiH样品光致变色并可以吸收可见光(400-800 nm)的实验现象。
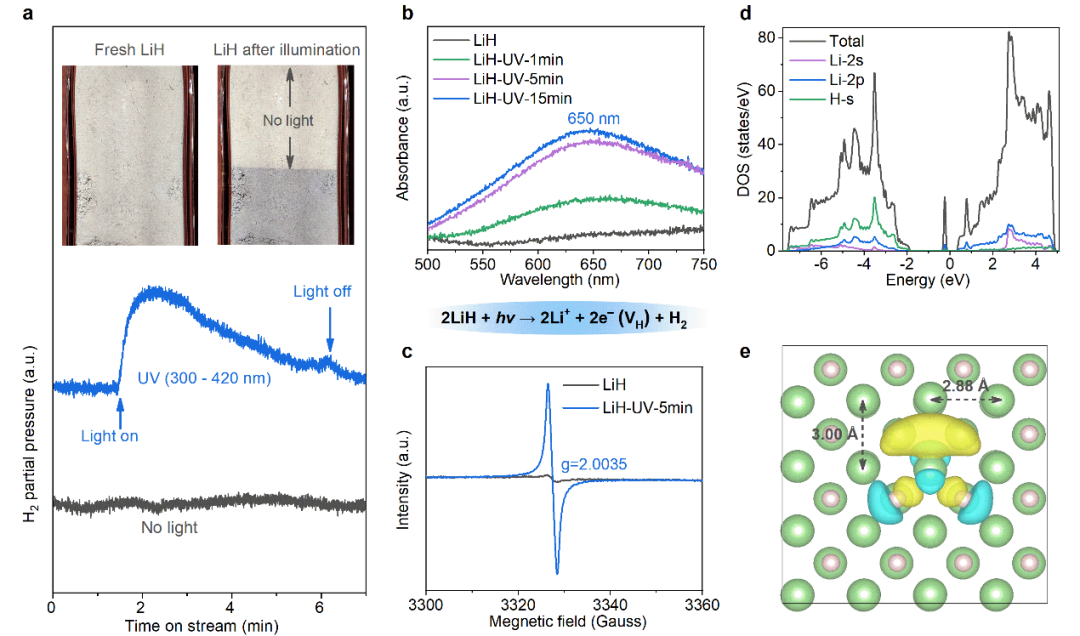
图1 LiH的光解。a. LiH样品在氩气中进行光脱氢实验时质谱检测的氢信号,插图为LiH 光照前后的照片;b. 不同光照时间后LiH样品的紫外-可见光谱;c. 光照前后的LiH样品的EPR谱图;d. 含有两个氢空位的LiH (100) 晶面的DOS;e. 含有两个氢空位的LiH (100) 晶面的表面电子分布 (黄色-负电荷,天蓝色-正电荷); 绿色和粉色小球分别代表Li和H。
LiH的光解与常见氧化物和氮化物半导体在光照下的表现存在本质差异。传统光催化剂光照产生的载流子容易发生复合而影响光催化效率。而LiH在光照过程中空穴可以氧化负氢并放氢形成氢空位,产生的光生电子则能储存在氢空位中,形成F心从而使表面呈现富电子的状态,这对后续化学转化过程具有重要作用。
光驱动氢化锂可逆加脱氢过程
LiH光解变色后持续通入氢气流,我们发现LiH样品逐渐褪色,并最终恢复到初始状态(图2a)。加氢20 min后的LiH样品的EPR信号强度明显减弱(图2b),这说明LiH的后续加氢可在常温常压下发生。我们后续进行了三个连续的光致脱氢及暗加氢循环,发现这一现象是可重复的。根据以上实验结果,LiH表面在常温常压下可实现光驱动可逆加脱氢过程。而LiH的热脱氢需要加热至900 K以上才能克服热力学的约束。这一结果显示光照为LiH介导的可逆储氢过程提供了一个解决方案。
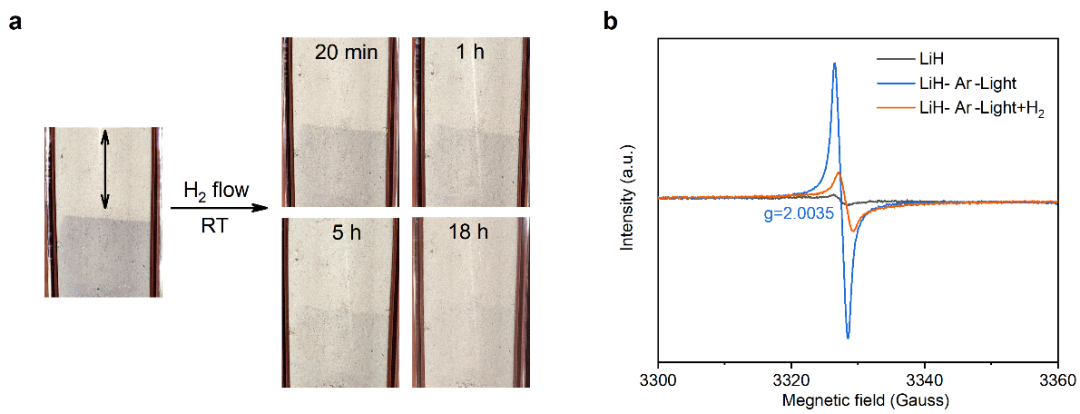
图2 光驱动LiH加脱氢过程。a. 紫外光照变色后的LiH样品在室温氢气流中的颜色变化;b. UV照射及加氢前后的LiH样品的EPR;c. LiH样品进行光照实验时质谱检测的氢信号。插入照片显示了LiH颜色的变化。黑色箭头表示无光照区域。
氢化锂介导光驱动固氮及合成氨
LiH的光解能产生氢空位和局域化的“活泼”电子,这为N2的还原提供有利的环境。我们在光照条件下引入了N2气(图3a),发现LiH在N2气流中释放的氢量更多。此外,在N2中光照后的样品的红外光谱中产生了N-H伸缩振动信号(3185,3240和3293 cm-1,图3b),这说明LiH样品在光照下具有固氮能力。
在密闭体系中对LiH光照固氮反应进行定量(图3c),发现其固氮速率可达518 μmol g-1 h-1,而光照时间进一步增加,固氮量基本保持不变,说明反应0.5 h后,LiH样品表面活性位点可能已被N物种完全占据。我们使用14N2和同位素15N2作为原料气,利用核磁共振氢谱(1H-NMR,图3d)发现产氨几乎完全为14NH4+和15NH4+,这证明了LiH的固氮来源于原料氮气。我们也初步探索了LiH光催化合成氨的过程,使用H2含量较低的N2/H2混合气作为原料气在光照下持续通入反应器中,如图3e所示,LiH样品催化合成氨速率为75 μmol gcat-1 h-1,在16 h内均保持稳定,说明LiH可实现光催化合成氨过程。
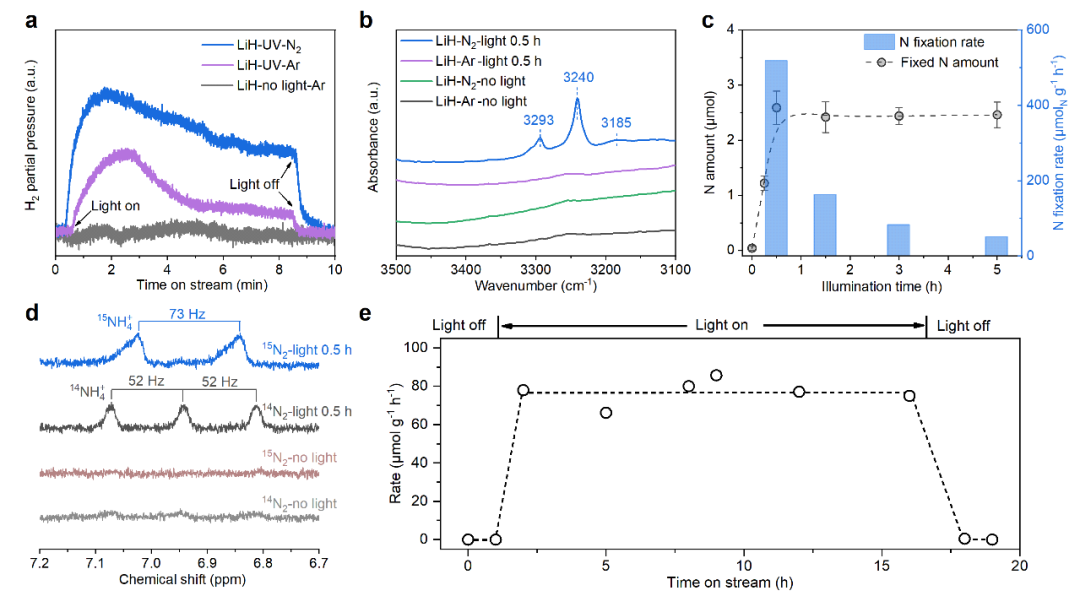
图3 LiH介导光驱动固氮及合成氨。a. LiH样品在N2或Ar气氛进行光照实验时质谱检测的氢信号;b. UV照射前后的LiH样品的FT-IR;c. 在N2气氛中光照不同时间后的LiH样品的固氮量及固氮速率;d. 使用14N2或同位素15N2作为原料气时,吸收尾气的稀硫酸溶液的1H-NMR谱图;e. LiH光催化合成氨活性测试。
综上,LiH对光的响应是光生载流子有效参与后续化学转化的关键。这一工作发现简单的二元氢化物LiH可以在光照下发生变色并脱氢,形成表面局部富电子的F心而有利于氮气的活化与转化,进而实现了LiH介导的光催化合成氨过程。除LiH外,许多碱金属氢化物和碱土金属氢化物亦是半导体,如BaH2、CaH2等,而混合阴离子氢化物如氧氢化物(oxyhydride)和氮氢化物(nitride-hydride)等材料的能带及电子结构则更加丰富。这项工作推开了氢化物光化学合成氨研究的大门,展现了氢化物在介导光化学反应中的发展潜力,我们期待氢化物在光化学合成氨中发挥更加重要的作用。
如果你是投资人、创业团队成员或科研工作者,对果壳硬科技组织的闭门会或其它科创服务活动感兴趣,欢迎扫描下方二维码,或在微信公众号后台回复“企业微信”添加我们的活动服务助手,我们将通过该渠道组织活动——