循环肿瘤DNA(circulating-tumor DNA,ctDNA)是指人体血液中肿瘤细胞体细胞DNA经脱落或者当细胞凋亡后释放进入循环系统,其中包含着癌症早期诊断和预后监测等重要信息。然而,ctDNA的精准检测面临着三大问题:(1)临床样本(例如血液、尿液、粪便等)成分复杂;(2)ctDNA的半衰期较短(< 2小时);(3)ctDNA丰度极低,仅占循环游离DNA(cfDNA)总量的0.5 ~ 10%。传统ctDNA富集和纯化通常是基于磁珠和二氧化硅膜,然而,当处理大量样品时,这些技术难以实现快速、高效的富集,并且操作复杂,检测灵敏度有限。因此,迫切需要一种创新的ctDNA富集与分析技术,以提高临床诊断的灵敏度。
据麦姆斯咨询报道,针对这一需求,北京航空航天大学樊瑜波、常凌乾、王杨等人在《ACS NANO》(IF: 17.1)期刊上发表了题为“An ion concentration polarization micro-platform for efficient enrichment and analysis of ctDNA” 的研究文章。该研究开发了一种基于离子浓度极化的微流控平台,能够在30秒内从血清、尿液和粪便等各种临床样品中快速、高效地富集和纯化ctDNA,并集成等温扩增模块,将ctDNA的检测灵敏度提高了100倍,显著消除了因ctDNA丰度低而导致的样本假阴性结果。
离子浓度极化(ICP)是一种新兴的原位分子富集和纯化方法,在阳离子选择性的Nafion膜上施加垂直电场,根据带电分子的电渗透力和电泳力进行分离和纯化。同时结合“自由流动”的概念,形成基于“自由流动ICP(FF-ICP)”的连续分离方法。对于带有负电荷的核酸分子,受到向下的电渗透力(EO)和不断增加的向上的电泳力(EP)的共同作用,被电动力学捕获,形成离子富集区。同时,施加连续的水平驱动力,使被富集到的核酸或蛋白分子水平推进并收集,从而进行后续的扩增分析(图1)。
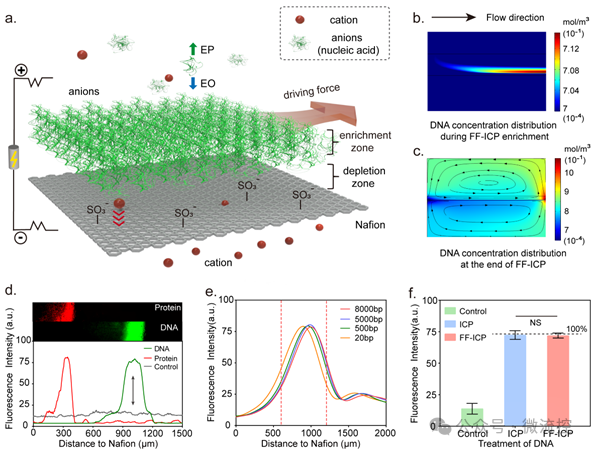
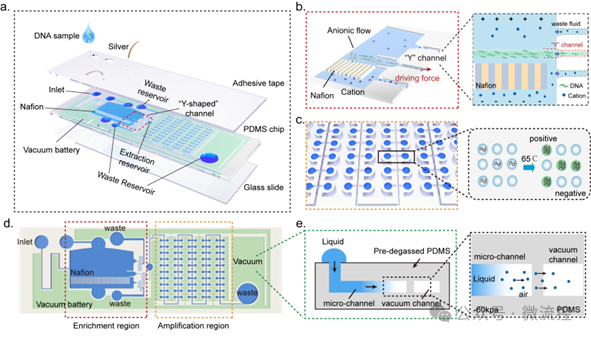
基于FF-ICP的DNA富集策略,研究团队设计了一种自供电、集成的微流控芯片,用于高灵敏度的核酸检测。该微流控平台有两个功能区:核酸富集区和核酸等温扩增检测区(图2a)。两个区域由一个“y形”提取通道连接。富集区内固定了阳离子选择性Nafion膜。在垂直电场和水平驱动力作用下,液体样品中的核酸被富集,形成“阴离子流”,然后在“y”形提取通道处收集(图2b)。随后,“阴离子流”进入检测区,经等温扩增后进行定量分析(图2c),剩余的溶液收集在废液池中(图2d)。
富集后的核酸进入到核酸扩增区之后,在含有100个微孔的检测区,用LAMP法进行等温扩增(65℃)。采用阳性微孔总数和每个微孔的荧光强度作为双参数指示,使分析更加准确和稳定。
为了给FF-ICP提供稳定的水平驱动力,研究团队在微流控芯片中集成了一个自供电真空电池系统。电池使用预脱气的PDMS,通过液体通道和真空通道之间的气体交换提供“电力”,从而推动液体样品流动(图2e),使得整个平台能够在不需要外部泵的情况下,连续地向下游输送和富集核酸分子,并进行核酸扩增,具有用户友好的性能。
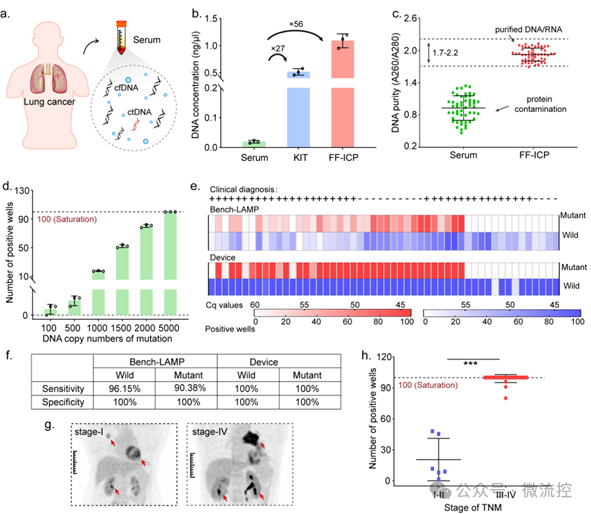
进一步研究结果表明,这种微流控平台可以用于检测临床患者血清中的ctDNA。与未处理样品相比,该微流控平台的富集效果和纯化能力明显高于试剂盒(图3a ~ 3c)。同时,最终的扩增结果也显示,该微流控平台能够达到100拷贝/mL的灵敏度,比传统方法(基于二氧化硅/磁珠的DNA提取与PCR扩增)提高了100倍(图3d)。
在临床应用中,研究人员对北京大学肿瘤医院提供的38例非小细胞肺癌患者的血清样本进行EGFR外显子19缺失突变的检测。结果表明,这种微流控平台的灵敏度显著高于传统PCR技术,达到了100%,能够大大避免了因ctDNA浓度不足而造成误诊的风险(图3e和3f)。此外,该微流控平台检测到的早期患者血清中ctDNA的含量明显低于中晚期患者,证明该平台的定量判断能力可以预测患者的肿瘤发展(图3g和3h)。此外,该微流控平台通过将分析物的提取和富集(FF-ICP)与进一步的生物分析技术进行无缝集成,为超低丰度生物标志物的检测带来巨大的好处。与传统检测技术相比,该平台的灵敏度显著提高了两个数量级,能够避免因浓度不足导致的误诊风险,尤其有利于临床感染筛查或者早期肿瘤诊断。
该研究第一单位为北航生物与医学工程学院和生物医学工程高精尖创新中心。通讯作者包括北航生物与医学工程学院常凌乾教授,樊瑜波教授,王杨副教授,上海感染与免疫科技创新中心徐高连研究员。核心作者包括北航博士生王之莹(第一作者)、硕士生刘明(共一)、北京大学肿瘤医院吴楠教授、北京大学第三医院林成浩主任(共一)等。


