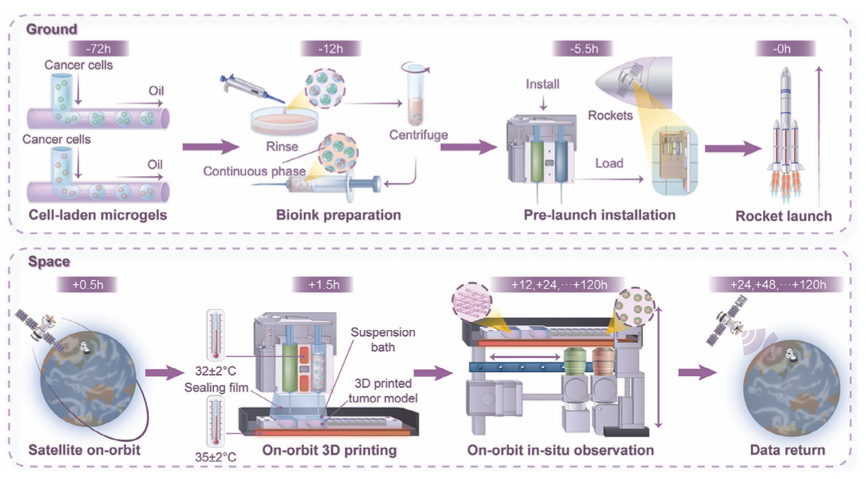
太空三维(3D)生物打印技术有助于构建精确的仿生肿瘤模型,可用于评估空间环境对肿瘤的复合效应,从而深入了解疾病的原理和潜在的治疗方法。目前太空3D生物打印面临一些困难,如发射前的不确定性、液体可能泄漏、太空中如何长期培养、设备自动控制、数据采集和传输等。
近日,来自清华大学的熊卓、张婷和方永聪教授团队进行了基于卫星在轨打印3D肿瘤模型的相关研究。该研究开发了一种结构强度高、体积小(220 mm × 250 mm × 150 mm)、重量轻(< 6 kg)的新型太空3D生物打印设备(图1)。基于微凝胶的双相热敏(MBT)生物墨水和悬浮介质,具有优异的存储性能和抗泄漏性,可适应潜在的发射延迟和振动,从而支持复杂肿瘤模型的在轨打印和原位培养。此外,该研究还开发了一种智能控制算法,能够自动控制3D打印、自动对焦、荧光成像和数据地面传输。该研究为首次通过卫星在太空中实现肿瘤模型在轨打印,其形态稳定,存活率适中。结果发现,3D肿瘤模型在太空中比在地球上对抗肿瘤药物更敏感。该研究为太空3D生物打印开辟一条新途径,为未来太空生命科学和医学研究提供新的可能性。研究成果以“Satellite-Based On-Orbit Printing of 3D Tumor Models”为题发表在Advanced Materials期刊上。

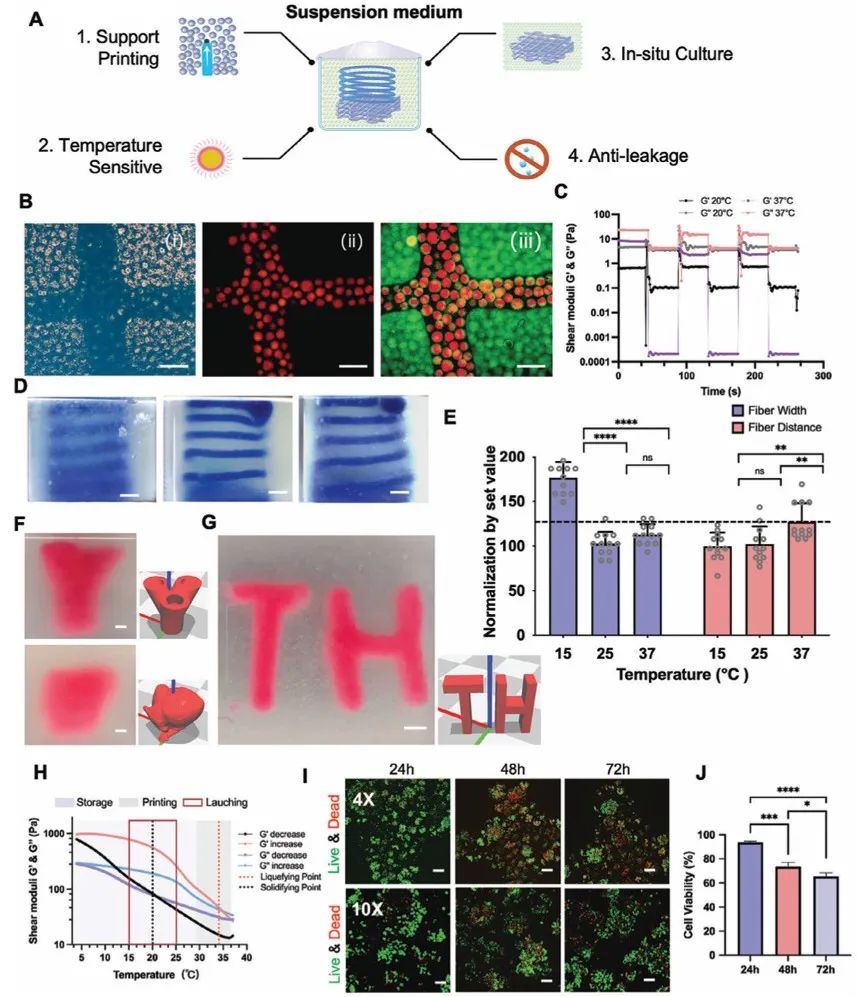
考虑到在卫星中无人操作和传统挤压式3D生物打印的固有局限性,原位培养过程通常很难进行灌注。主要因为在液体灌注过程中,气液界面容易产生大量气泡。因此,科研人员开发了一种嵌入式3D生物打印策略,利用一种悬浮培养基既能3D打印MBT生物墨水,又能原位培养打印出的肿瘤模型(图3A)。MBT悬浮培养基由分散相GelMA凝胶和连续相明胶及透明质酸(HA)复合材料组成。结果表明,MBT悬浮培养基可用于高保真打印复杂结构(图3B)。荧光成像显示,MBT悬浮介质主要由类似于MBT生物墨水的微凝胶组成。流变测试表明,MBT悬浮介质具有剪切稀化和自愈合特性(图3C),有利于嵌入式打印。对嵌入打印的螺旋结构进行定量测量表明,丝的宽度和间距受打印温度影响不大(图3D、E),表明MBT悬浮介质具有较宽的打印温度范围。虽然微颗粒大大降低MBT悬浮介质的不透明度,但嵌入打印结构的轮廓仍清晰可见。研究人员还打印了人体解剖结构(如人的支气管和心脏,图3F)和带有悬臂的结构(如垂直的TH管,图3G),用于展示打印能力。使用传统的挤压打印方法很难打印出具有悬臂和薄壁等复杂结构的构造物。由于明胶的存在,MBT悬浮介质在加热阶段的凝胶-溶胶转变点为35°C,在冷却阶段的溶胶-凝胶转变点为20°C。将MBT悬浮培养基注入生物模块后,在4℃下迅速凝固。凝胶化后,MBT悬浮介质即使倒置也不会在容器内流动。采取这种预防措施是为了防止MBT悬浮介质在半开放舱内泄漏,在火箭发射过程中的剧烈振动可能会导致这种泄漏发生。在37℃的MBT悬浮培养基中培养的打印构建体在72 h内保持较高的细胞活力。以上结果表明,MBT悬浮培养基可支持复杂构建物在30 ~ 37°C下嵌入打印和原位培养,同时在4 ~ 25°C下经受长途运输而不会发生泄漏。
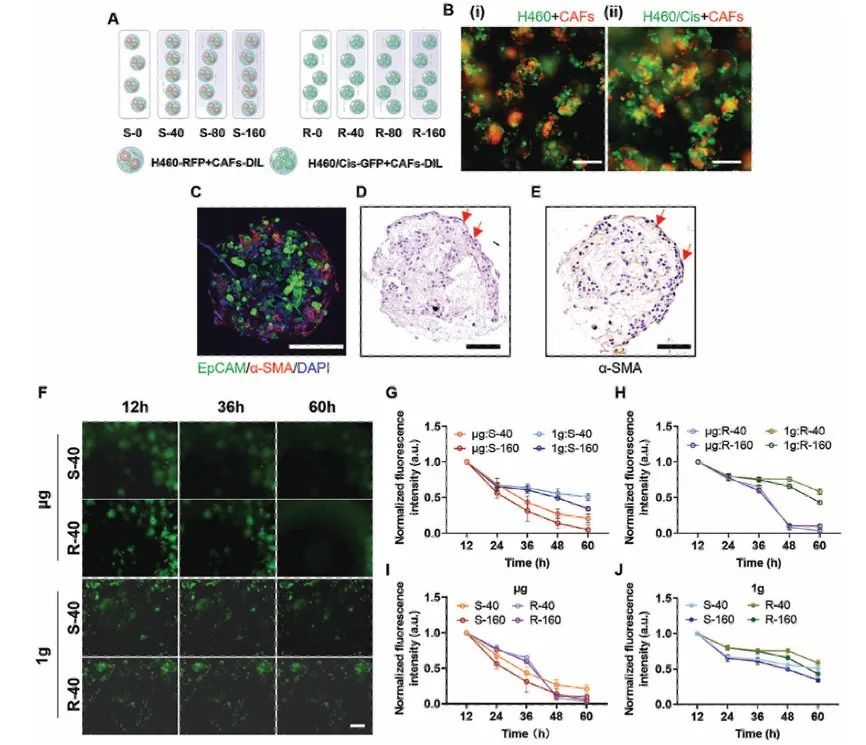
综上所述,该研究开发了一种新型适用于太空的生物打印设备,可以在太空中打印和培养3D肿瘤模型。研究结果表明,所开发的MBT生物墨水和MBT悬浮培养基能够在很宽的温度范围内打印3D肿瘤模型,并能在轨道上实现形态稳定、细胞活力适中的培养。本文在卫星上对多功能实验装置和太空生物打印技术成功进行了在轨验证,标志着太空3D生物打印技术的发展迈出重要一步,为加速太空生物学和医学研究与发展提供新的机遇。


