★
欢迎星标 果壳硬科技
★
研究团队 | 作者
酥鱼 | 编辑
2023年12月20日,德国马克斯·普朗克陆地微生物研究所的Tobias J. Erb教授团队在Nature Catalysis发表了题为Construction and modular implementation of the THETA cycle for synthetic CO2 fixation的研究论文。
该研究设计了一条人工二氧化碳(CO2)固定途径:THETA循环,并在体外构建及优化了此循环,更进一步地将其以模块化的方式植入大肠杆菌中。本研究迈出了将复杂人工固碳途径移入细胞内的第一步。
论文通讯作者是Tobias J. Erb、罗姗姗;第一作者是罗姗姗。

摘要
面对气候变化的迫切挑战,开发创新的CO2捕集与转化技术至关重要。合成生物学带来了新的可能性,使我们能够设计出自然界中不存在的CO2固定新途径,其效率可超越现有的自然固碳途径。然而,将这些创新设计实现、优化并在各种体外与体内系统中应用仍然充满挑战,特别是在体内环境中构建复杂的人工CO2固定途径,目前还没有成功案例。
本研究展示了一条新的人工CO2固定途径——THETA循环——的设计与构建。该循环包含17步酶促反应,基于两种自然界中已知最高效的固碳酶:巴豆酰辅酶A羧化酶/还原酶(Ccr)和磷酸烯醇式丙酮酸羧化酶(Ppc),能将CO2转化为中心代谢产物乙酰辅酶A。该循环首先在体外被成功构建,经过理性设计与机器学习优化策略,其产量提高了百倍。进一步地,THETA循环被分成三个模块并独立地引入大肠杆菌中。利用大肠杆菌代谢途径的可塑性,采用生长选择和/或13C同位素标记,三个模块均被验证在宿主细胞中成功运行。这标志着在活细胞中构建复杂且高度正交的人工CO2固定途径的第一步。
内容
为了设计出高效的人工固碳循环,本研究首先选择了性能优异的固碳酶:Ppc和Ccr,并采用了模块化的方式进行设计。首先,基于Ppc设计出了一个代谢途径模块将三碳化合物丙酮酸转化为四碳化合物琥珀酸(模块1);基于Ccr设计出了另一个代谢途径模块将四碳化合物巴豆酰辅酶A转化为三碳化合物丙酮酸和二碳化合物乙酰辅酶A(模块3)。为了将这两个模块连接起来形成一个循环,设计出了一个模块将琥珀酸转化为巴豆酰辅酶A(模块2)。至此,三个模块共同构成了一个完整的固碳循环,每循环一次可将两个CO2分子转化为一个乙酰辅酶A。这个循环被称为THETA循环(图1b)。
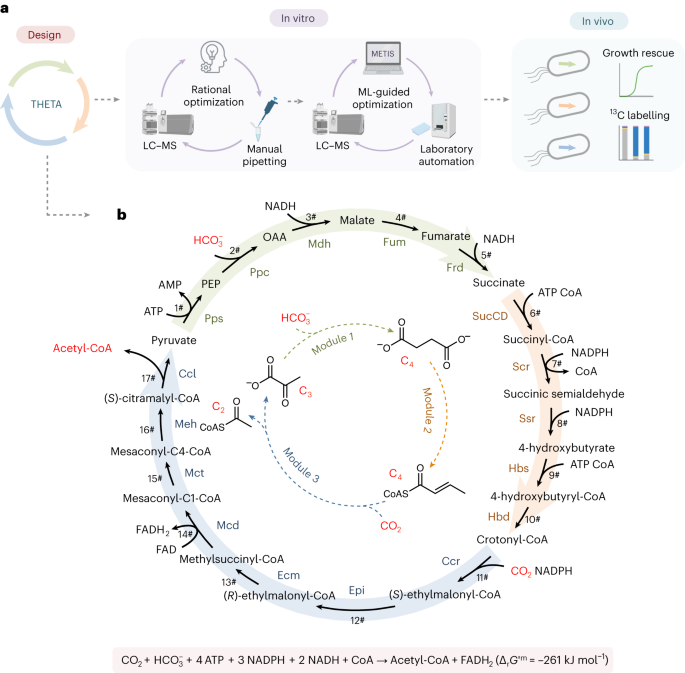
图1|THETA循环及其实现策略
本研究首先在体外环境下用纯化的酶构建THETA循环。在构建过程中发现循环中的酶SucCD会催化副反应而产生无法进入循环的代谢物,这个问题通过引入酶Mcl2将此代谢物重新引入循环而得以解决(图2a)。之后发现循环中的限速步是Frd反应,因为所选用的Frd酶的活性很低,但是并没有更好的Frd酶可供选择。于是本研究设计了一个由两个酶构成的Frd旁路(图2a),使用这一旁路使产量提高了5倍多(图2b)。之后又采用了机器学习模型METIS结合实验室自动采样系统(Echo)进行了9轮优化,在测试过270个不同条件后,找到了更优的反应条件,将产量进一步提高了4-5倍(图2c,d)。至此,THETA在体外环境下成功构建,其产量从版本1到版本3.9.9提高了两个数量级。
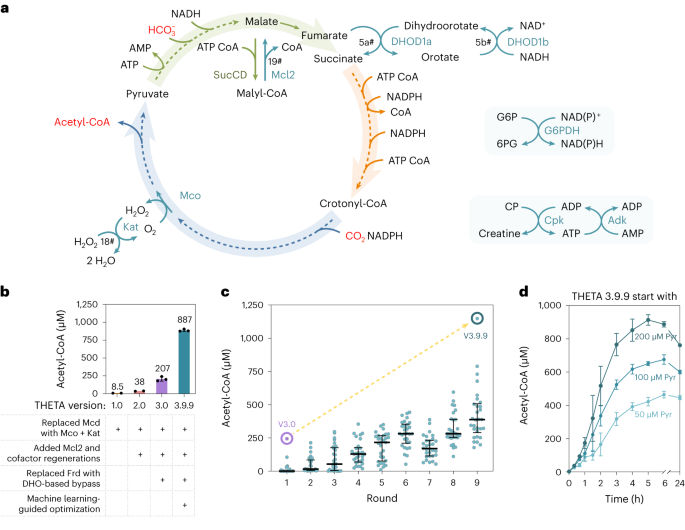
图2|THETA循环的体外证明及优化
为了拓展THETA循环的体外应用,本研究拓展THETA循环以生产生物构建分子丙二酰辅酶A(图3a,b)和乙醇酸(图3c,d)。
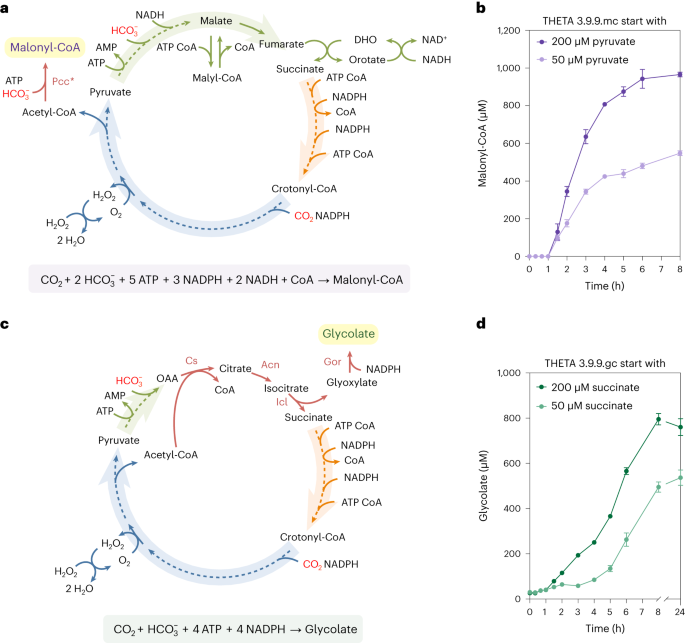
图3|THETA循环的体外拓展
为了进一步验证THETA循环在体内环境中的可行性,本研究将THETA循环分成三个模块分别引入大肠杆菌中(图4a)。模块1将丙酮酸转化为琥珀酸,通常情况下大肠杆菌在厌氧条件下会运行此代谢途径。为了使大肠杆菌在有氧条件下运行该途径,本研究阻断了三羧酸循环和乙醛酸支路,使细胞不可生成琥珀酰辅酶A(图4b)。实现模块1只需要表达一个基因,当该基因被引入后细胞可重新合成琥珀酰辅酶A而恢复生长(图4c),证明模块1在细胞内成功运行。模块2的证明使用了乙酰辅酶A营养缺陷型菌株。本研究引入了三个酶可将模块2产物巴豆酰辅酶A转化为乙酰辅酶A(图4d),在引入模块2后,此筛选菌株恢复生长,证明了模块2在细胞内运行(图4f,g)。
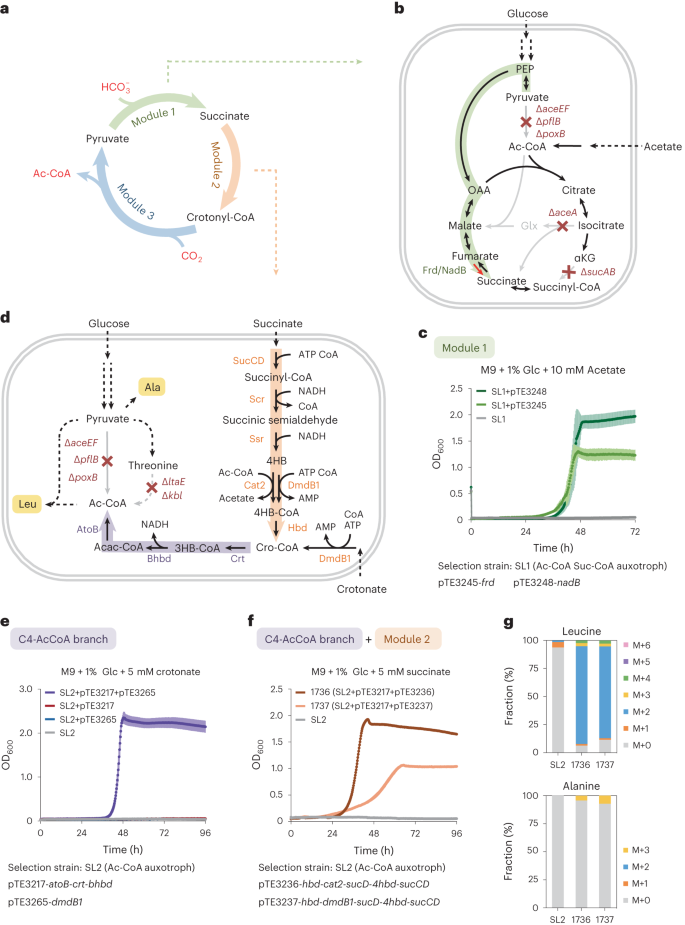
图4|THETA循环模块1和模块2的体内构建
模块3是最复杂的一个模块,引入筛选菌株后并没有使细胞恢复生长,于是本研究进行了细胞培养液代谢组学分析。结果显示大肠杆菌内的硫酯酶会将甲基琥珀酰辅酶A转化为甲基琥珀酸,之后大肠杆菌的天然Sdh会将其进一步转化为中康酸(图5c)。于是本研究利用大肠杆菌的天然代谢途径,设计了“酸旁路”的模块3(图5b),并利用13C同位素标记的方法证明了模块3在细胞内成功运行(图5f)。
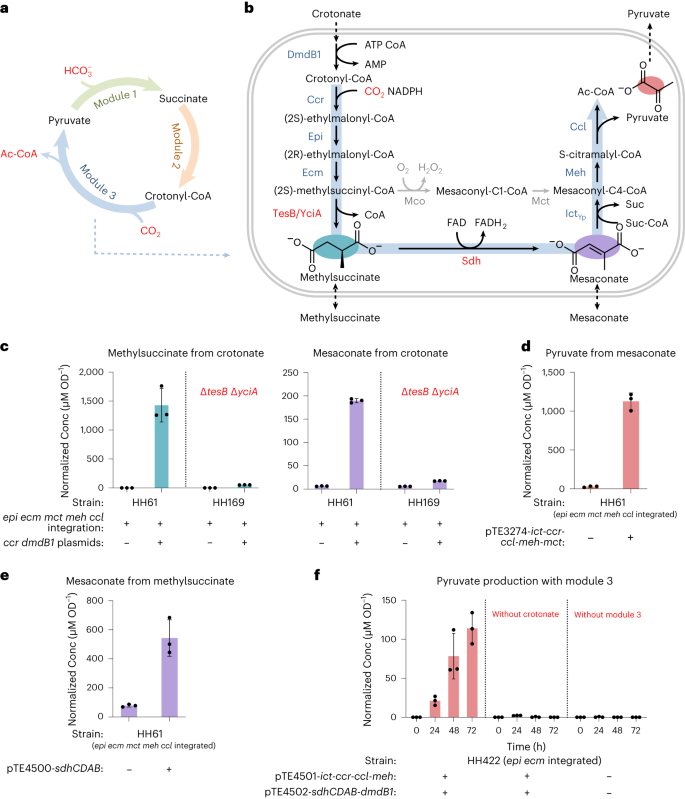
图5|THETA循环模块3的体内构建
总结
本研究设计了一个新的人工固碳循环:THETA循环,在体外环境中构建及优化了该循环,并将其以模块化的方式植入大肠杆菌的代谢网络中。THETA循环的三个模块已成功在体内运行,这为将来实现完整的体内THETA循环奠定了基础。然而,其实现仍需要更进一步的理性设计和大量的实验室定向进化,以实现引入的人工途径与天然代谢网络,代谢负担,以及基因调控之间的微妙平衡。实现完整THETA循环的体内运行将验证在体内环境下构建高度复杂且正交的人工代谢途径的可能性,同时也将使目前设计的最有希望的人工固碳途径之一引入生命体中。
如果你是投资人、创业团队成员或科研工作者,对果壳硬科技组织的闭门会或其它科创服务活动感兴趣,欢迎扫描下方二维码,或在微信公众号后台回复“企业微信”添加我们的活动服务助手,我们将通过该渠道组织活动——