患者来源的癌症类器官(PDOs)在个性化治疗选择和改善患者预后方面具有相当大的前景。然而,在标准培养平台上生成足够数量的PDOs以测试疗法具有挑战性。对于胰腺导管腺癌(PDAC)来说,这一挑战尤为严峻,因为大多数胰腺导管腺癌患者都是在患病晚期才被诊断出,此时,患者已失去了手术的机会,因此,患者的组织活检通常都是通过针刺形式进行。
据麦姆斯咨询报道,近期,美国梅奥医疗集团(Mayo Clinic)Alexander Revzin及其团队研究了微流控装置的开发和特性,用于测试使用有限数量的组织或PDOs的治疗。结果表明,微流控PDOs在表型和基因型上与金标准基质胶类器官相似,且具以下优点,包括:(1)形状均匀;(2)最小细胞数要求;(3)不依赖基质胶。此外,研究人员通过测试PDOs对几种化疗的反应证明了微流控PDOs的实用性。此外,研究人员利用微流控PDOs验证了由NK细胞结合一种新型生物制剂组成的免疫治疗的有效性。总之,该研究开发的微流控装置在癌症活检方面具有良好的应用前景,并可能在未来发展成为化疗或免疫治疗的辅助诊断。相关研究内容以“Microfluidic Organoid Cultures Derived from Pancreatic Cancer Biopsies for Personalized Testing of Chemotherapy and Immunotherapy”为题发表在Advanced Science期刊上。
具体而言,本研究开发了用于类器官培养的微流控装置,该装置包含微孔阵列(直径250 μm),用于促进细胞聚集成球状体(图1)。
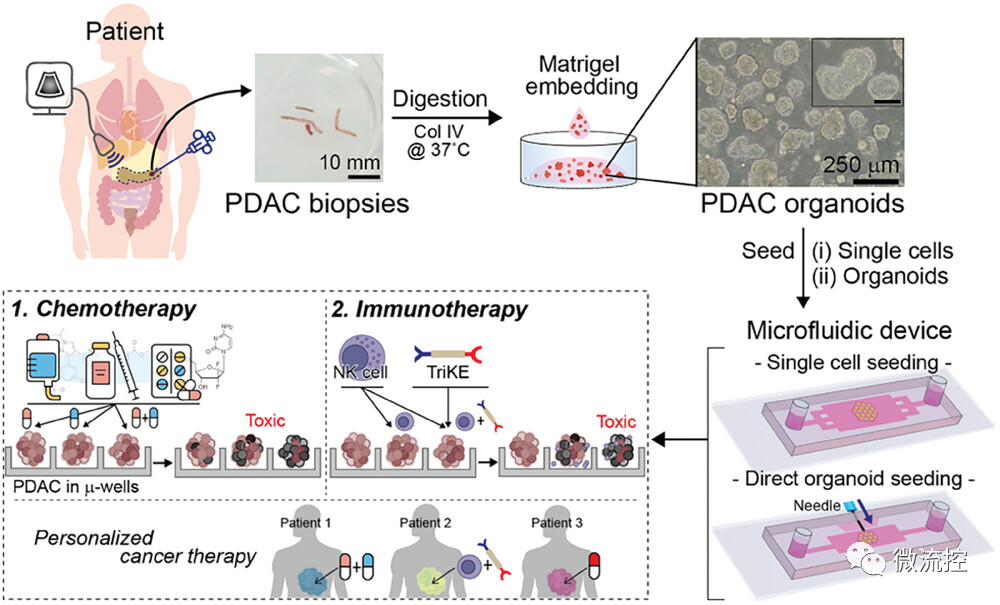
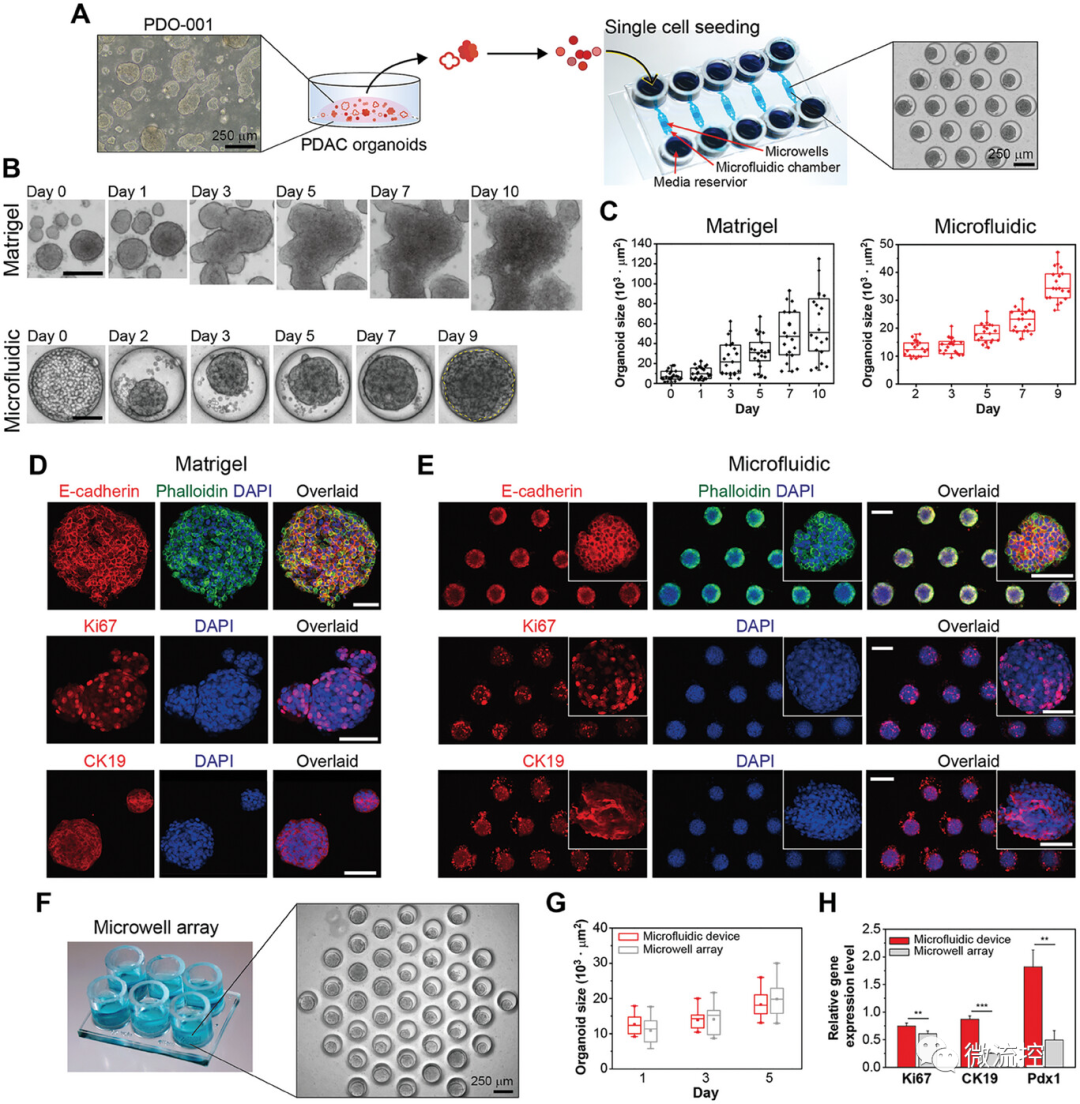
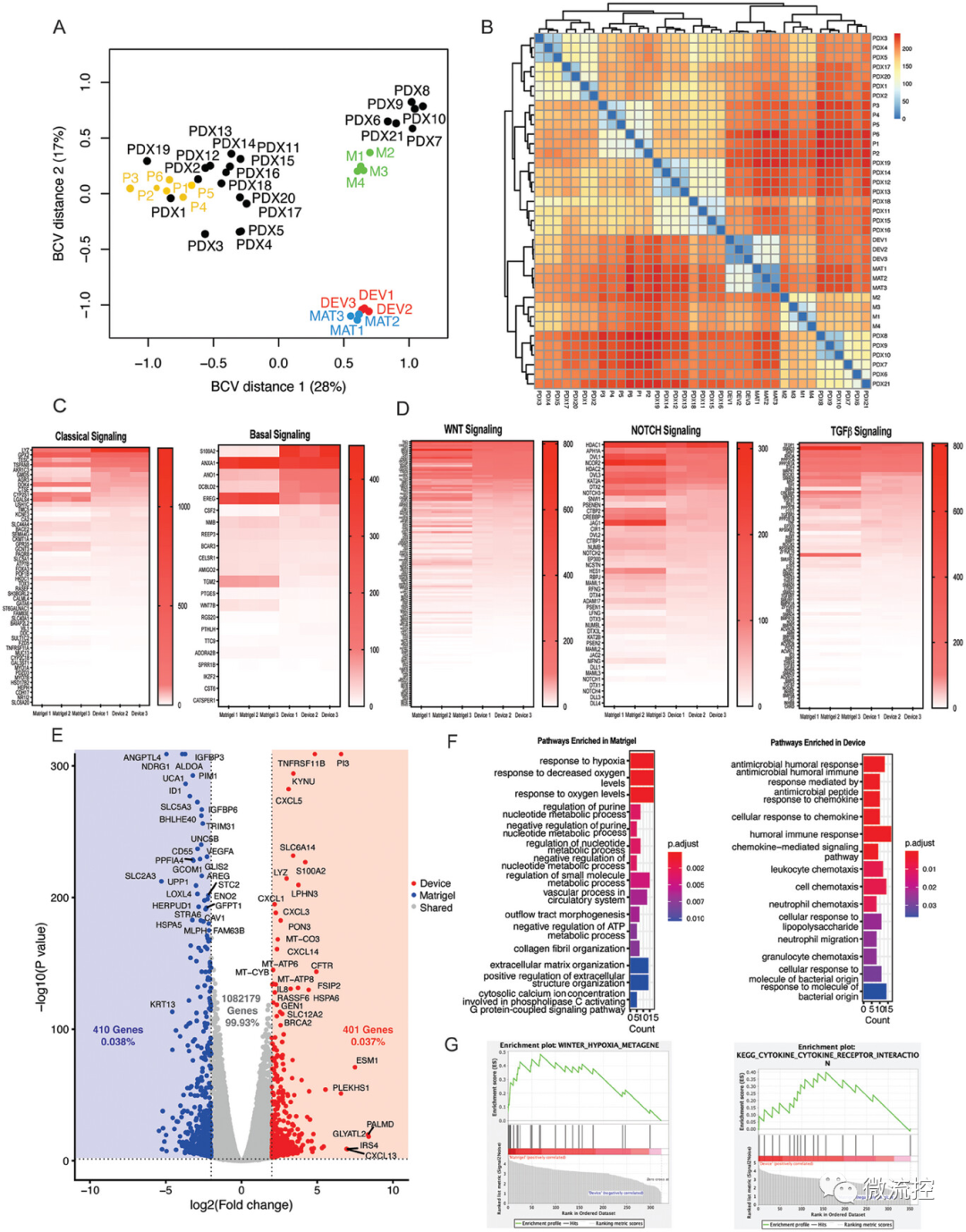 图3 基质胶和微流控类器官培养物的转录组学比较
图3 基质胶和微流控类器官培养物的转录组学比较
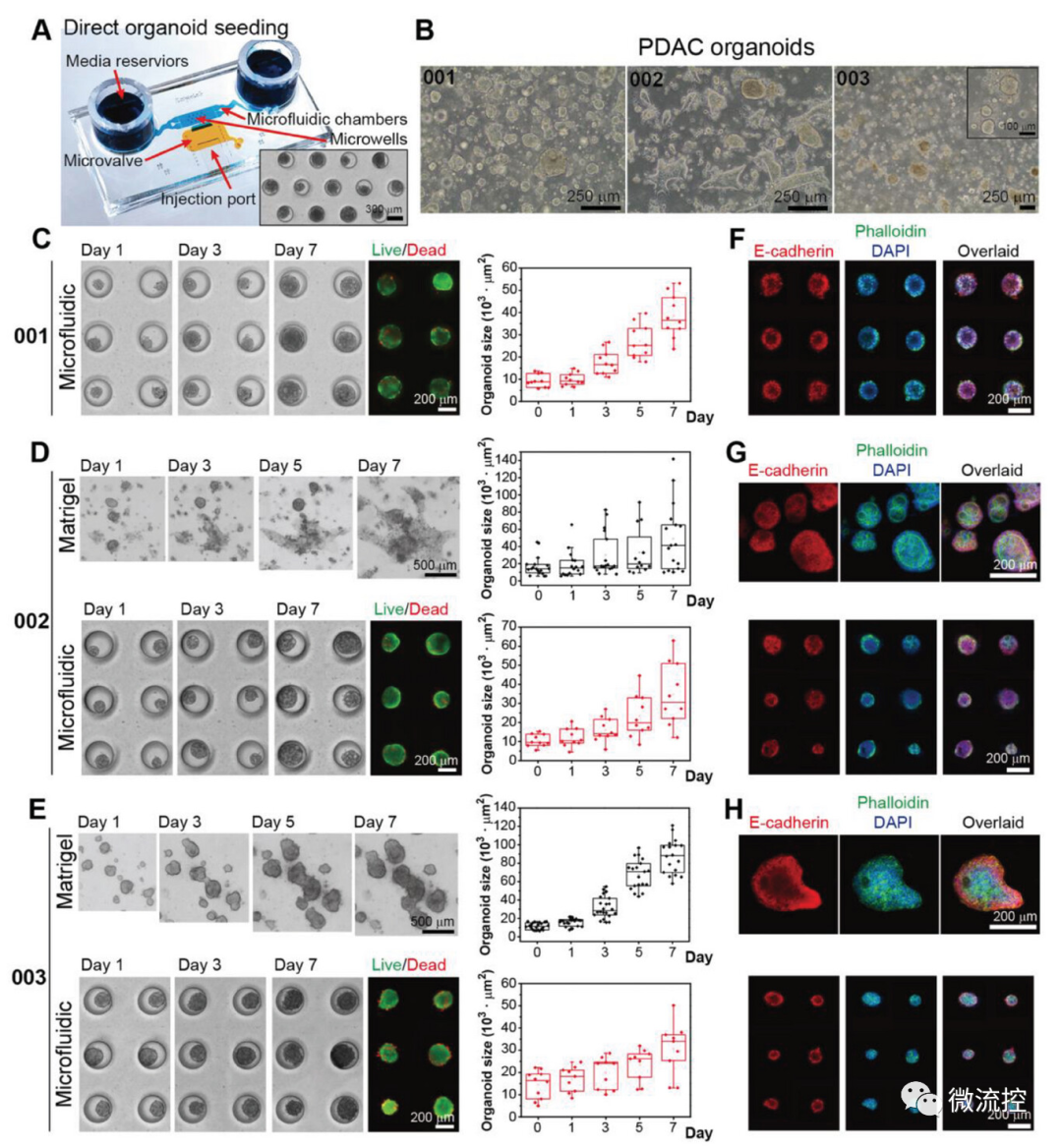
此外,这种新型微流控装置有一个由常闭阀门保护的侧注射端口(图4A)。比较来自三个不同患者的类器官,分别为PDO-001、PDO-002和PDO-003,在微流控装置和基质胶培养的图像如图4B所示。微流控类器官培养表现出基质胶中观察到的特征,PDO-001和PDO-002表现出腔/导管结构(图4C、4D),PDO-003形成紧凑的球状体(图4E)。3例患者的微流控类器官培养物均对上皮标记物E-钙粘蛋白、胰腺导管腺癌标记物CK19和增殖标记物Ki67的染色强阳性(图4F-4H)。以上结果证明来自三种不同胰腺导管腺癌活检的完整类器官可以在新型微流控装置中培养,该装置具有增殖标记和上皮/癌症表型表达,与金标准基质胶类器官培养物相似。
随后,研究人员将胰腺导管腺癌类器官对分子靶向治疗的反应与GEM进行比较,GEM是一种抑制DNA合成并导致癌细胞凋亡的一线化疗药物(化学结构见图5A)。在微流控装置中,单细胞经过2天的培养形成球状体,之后给药7天(流程见图5A)。药物治疗前(第0天)和药物治疗后(第7天)微流控类器官培养物的亮场和活/死染色图像如图5B所示。研究结果显示,这些类器官对GEM的敏感性更高(图5E)。
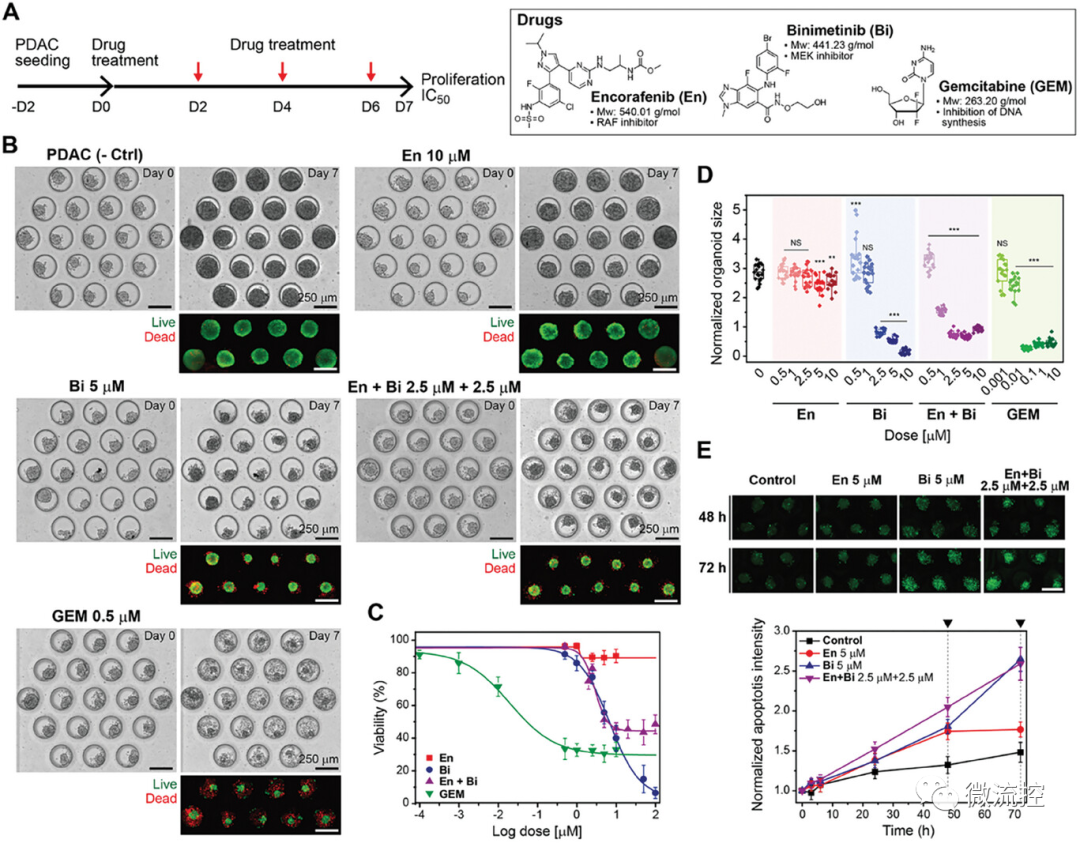
联合化疗的时间线如图6A所示。观察到联合治疗的患者特异性差异(图6B-6G)。在暴露于药物的PDO-001类器官中观察到有限的细胞毒性(图6B、C),而PDO-002和PDO-003在所有浓度范围内都显示出对联合治疗的反应都增强(图6D-6G)。
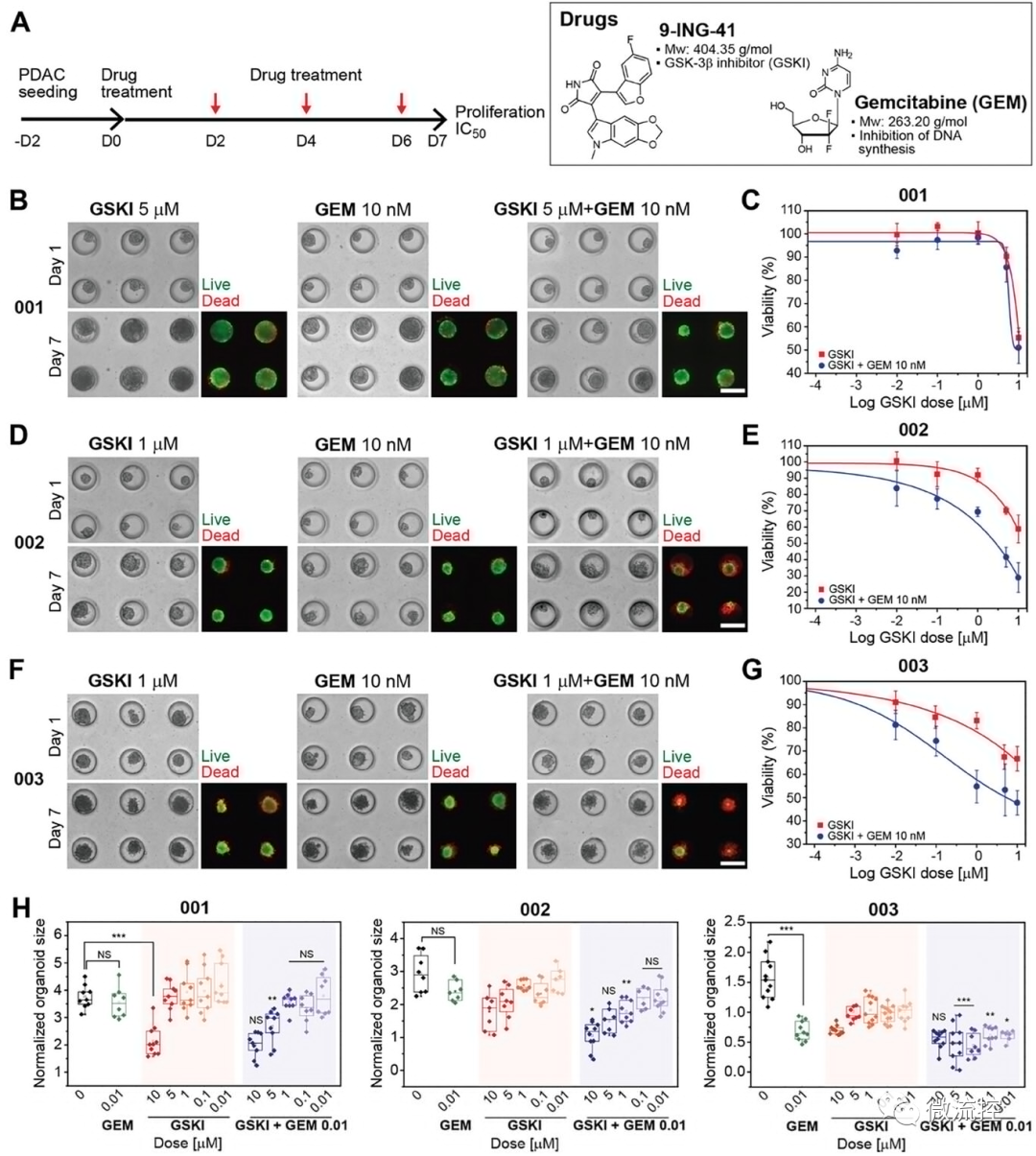 图6 使用三种患者特异性微流控类器官培养物的GSKI和GEM检测联合治疗
图6 使用三种患者特异性微流控类器官培养物的GSKI和GEM检测联合治疗
实验时间线如图7A所示,抗B7-H3 TriKE增强NK细胞对肿瘤细胞杀伤的机制如图7B所示。对于3种PDOs,癌症类器官的单培养在微流控装置内持续生长(图7C,72 h)。为定量评估类器官生长,每24小时追踪单个类器官直径,将24、48和72小时的直径归一化到0小时的初始大小,并绘制所有胰腺导管腺癌样本每种条件下的平均类器官直径(图7D)。所有癌症类器官24小时大小减小60%。研究结果表明,抗B7-H3 TriKE提高了NK细胞对癌症类器官的溶细胞活性,也强调了微流控癌症类器官培养的效用。
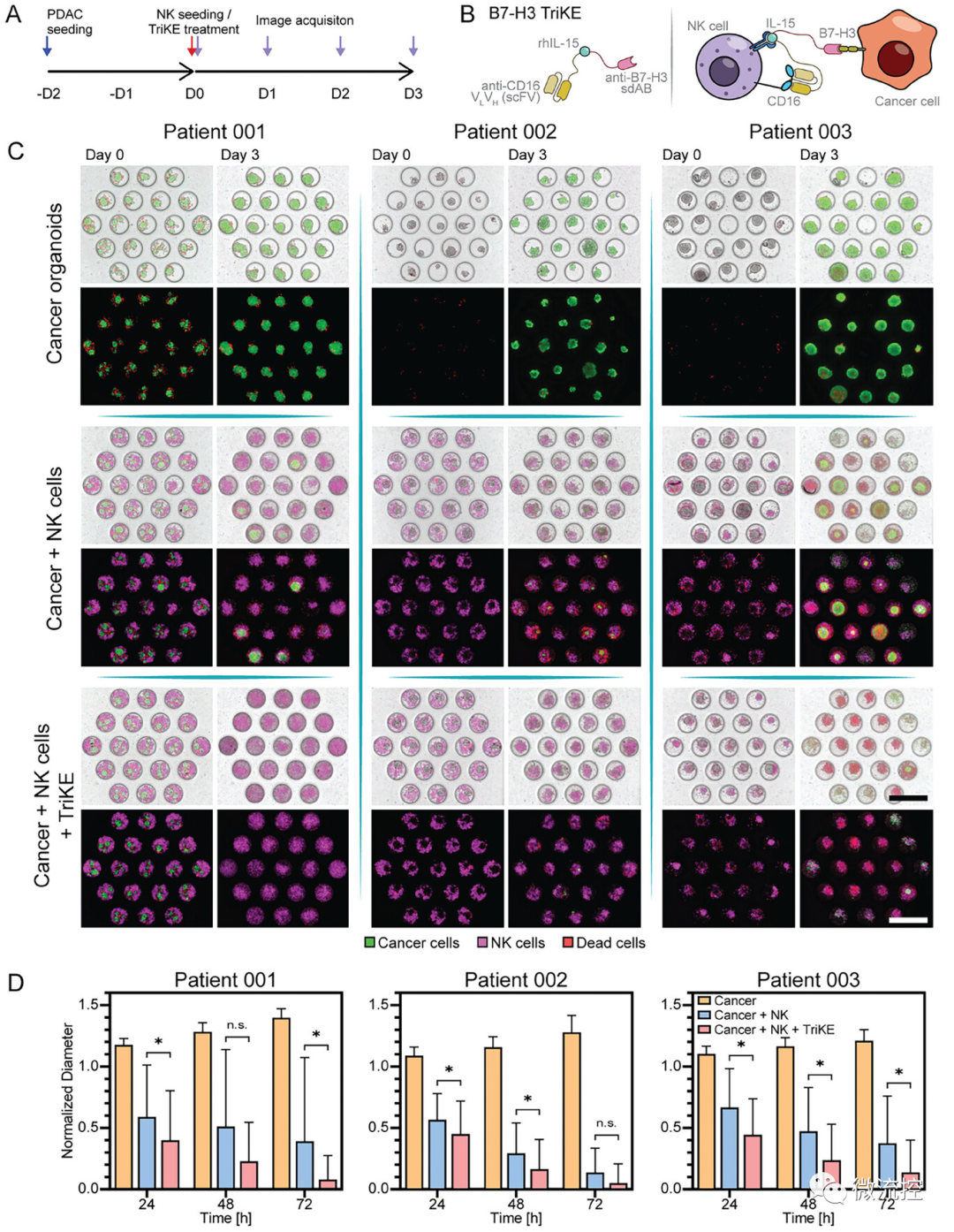
综上所述,本研究开发并表征了新型的胰腺导管腺癌类器官微流控培养物,证明了微流控装置在类器官增殖和癌症表型表达以及免疫细胞的激活和浸润方面优于微孔阵列格式。RNA测序分析显示,微流控类器官培养物与金标准基质胶培养物相似,在微流控形式下具有更好的氧合和启动趋化因子信号和免疫细胞浸润。在未来,该微流控平台可能与生物传感能力集成,用于定量评估单个类器官,并可能发展成为个性化癌症治疗的辅助诊断。



