可用性一般指在预期使用环境中,能够顺畅使用,从而具有有效性、效率、用户易学和用户满意的用户接口特性。
通标GB 9706.1中涉及可用性的条款

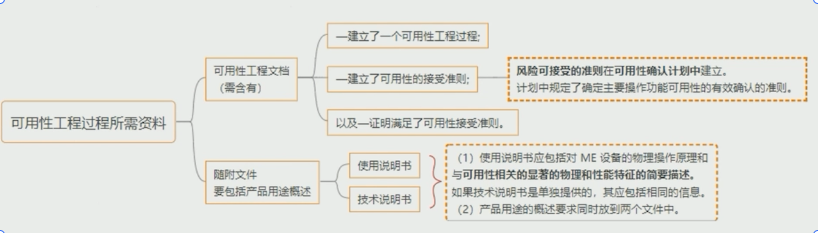
可用性过程所需的资料
可用性(Usability)是指预期用户在预期使用场景下正常使用医疗器械时,保证医疗器械安全有效使用的用户接口易用特性。易用特性包括但不限于易读性、易理解性、易学习性、易记忆性、易操作性、用户差错防御性等特性。可用性工程亦称人因工程、人机工效学/人体工程学。
可用性设计/人因设计是综合运用关于人类的解剖、生理、心理、行为、文化等方面能力与限制的人因工程知识来设计开发医疗器械,以增强医疗器械的可用性。人因工程知识包括但不限于身体、感知、认知、行动等方面知识。
医疗器械可用性的法规要求:
*中国:
-YY/T 1474-2016医疗器械 可用性工程对医疗器械的应用
-医疗器械人因设计技术审查指导原则
*欧盟:
-IEC 62366-1:2015+AMD1:2020 Medical devices - Part 1: Application of usability engineering to medical devices
-IEC TR 62366-2:2016 Medical devices - Part 2: Guidance on the application of usability engineering to medical devices
-IEC 60601-1-6:2010+AMD1:2013+AMD2:2020 Medical electrical equipment - Part 1-6: General requirements for basic safety and essential performance - Collateral standard: Usability
*美国:
-Applying Human Factors and Usability Engineering to Medical Devices 2016-2-3
可用性过程:这里以IEC 62366-1:2015+AMD1:2020进行说明可用性工程的过程:
编写使用规范:识别出医疗器械的预期用途、适用对象、适用环境和用户特征等;
识别与安全相关的用户接口特性和潜在使用;
识别已知的或可预见的危险和危险情况:
识别和描述危险相关使用场景;
为总结性评价选择危险相关使用场景:
建立用户接口规范;
建立用户接口评价计划;
进行用户接口设计、实现和形成性评价;
进行用户接口可用性的总结性评价;
未知来源的用户接口。
参考附件:
医疗器械人因设计注册审查指导原则
(第二次公开征求意见稿)
中国医疗器械行业协会 - 关于第二次公开征求《医疗器械人因设计注册审查指导原则(征求意见稿)》意见的通知 (camdi.org)
本指导原则旨在指导注册申请人建立医疗器械人因设计过程和准备医疗器械人因设计注册申报资料,同时规范医疗器械人因设计技术审评要求。
本指导原则是对医疗器械人因设计的一般要求。注册申请人需依据产品具体特性和风险程度确定本指导原则具体内容的适用性,若不适用详述理由。注册申请人也可采用其他满足法规要求的替代方法,但需提供详尽的支持资料。
本指导原则是在现行法规、强制性标准体系以及当前科技能力、认知水平下制定的,随着法规、强制性标准体系的不断完善以及科技能力、认知水平的不断发展,本指导原则相关内容也将适时调整。
本指导原则是供注册申请人、审评人员和检查人员使用的指导文件,不涉及行政审批事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。
本指导原则是医疗器械人因设计的通用指导原则,其他医疗器械指导原则可在本指导原则基础上结合具体情况进行有针对性的调整、修改和完善。
如需下载原文请扫描下方二维码
