★
欢迎星标 果壳硬科技
★
研究团队 | 作者
施欣冶、刘文静 | 编辑
王攀 | 审核
研究成果概述
近日,浙江大学光电科学与工程学院郝翔、韩于冰研究员提出了基于有机小分子探针的膨胀-受激辐射损耗显微术(expansion stimulated emission depletion based on small-molecule organic probes, SMOP-ExSTED),实现了三维多色亚十纳米分辨率超分辨成像。研究团队通过开发新型的小分子荧光探针,解决了膨胀显微术中荧光标记密度和亮度难题,结合三维自适应STED系统,以纳米级分辨率实现了多种亚细胞结构及其相互作用解析。2023年9月25日,该研究成果以“Three-dimensional multi-color optical nanoscopy at sub-10-nm resolution based on small-molecule organic probes”为题以封面文章的形式发表在Cell Reports Methods杂志。

论文截图
背景介绍
光学超分辨率显微术在过去的几十年经历了飞速发展,并在生命科学、医药等领域得到了广泛应用。与经典超分辨显微术不同,膨胀显微术(expansion microscopy, ExM)可以在水凝胶的支撑下,通过对生物标本的物理放大而进行高分辨率成像。原则上,将样品膨胀与其他超分辨显微术相结合可能获得更高的分辨率。然而,对于几乎所有的超分辨显微镜技术而言,分辨率很大程度上取决于光子数(即荧光亮度);而ExM则会引起单位体积内荧光标记密度和强度的大量损失。这一矛盾使得两者的直接结合难以突破三维亚10纳米分辨率。尽管现有技术倾向于通过抗体(一抗、二抗复合物尺寸约为20 ~ 30 nm)或荧光蛋白(~5 nm)的多次复用来提高标记亮度和密度,但这些标记物的巨大尺寸在较高分辨率时引入了难以接受的标记误差。
小分子有机探针(small-molecule organic probes, SMOPs)具备较小的尺寸(<1 nm)和更强的荧光亮度,如果应用于ExM,可以实现更高的标记密度,因而有可能进一步提高分辨率。然而,现有的小分子荧光探针还存在两方面不足,限制了其在膨胀-超分辨显微成像中的应用:(1)传统的荧光探针与膨胀显微术不兼容,会随着样品膨胀的过程从水凝胶中脱落;(2)对于大多数探针来说,如何抵抗超分辨成像所需的高强度激光辐射也是极大的挑战。
文章亮点
浙江大学光电科学与工程学院郝翔、韩于冰研究团队在前期三维自适应受激辐射损耗显微镜(expansion stimulated emission depletion, STED)的研究基础上,提出新型有机小分子探针设计,同时兼容ExM的样品制备及STED对荧光亮度、抗漂白能力的要求,解析了微丝纤维、溶酶体、线粒体等多种亚细胞结构的精细分布和空间相互作用,实现了多色三维亚十纳米分辨率超分辨成像,为纳米级分辨率光学成像实现细胞生物学问题解析提供了新的研究范式。
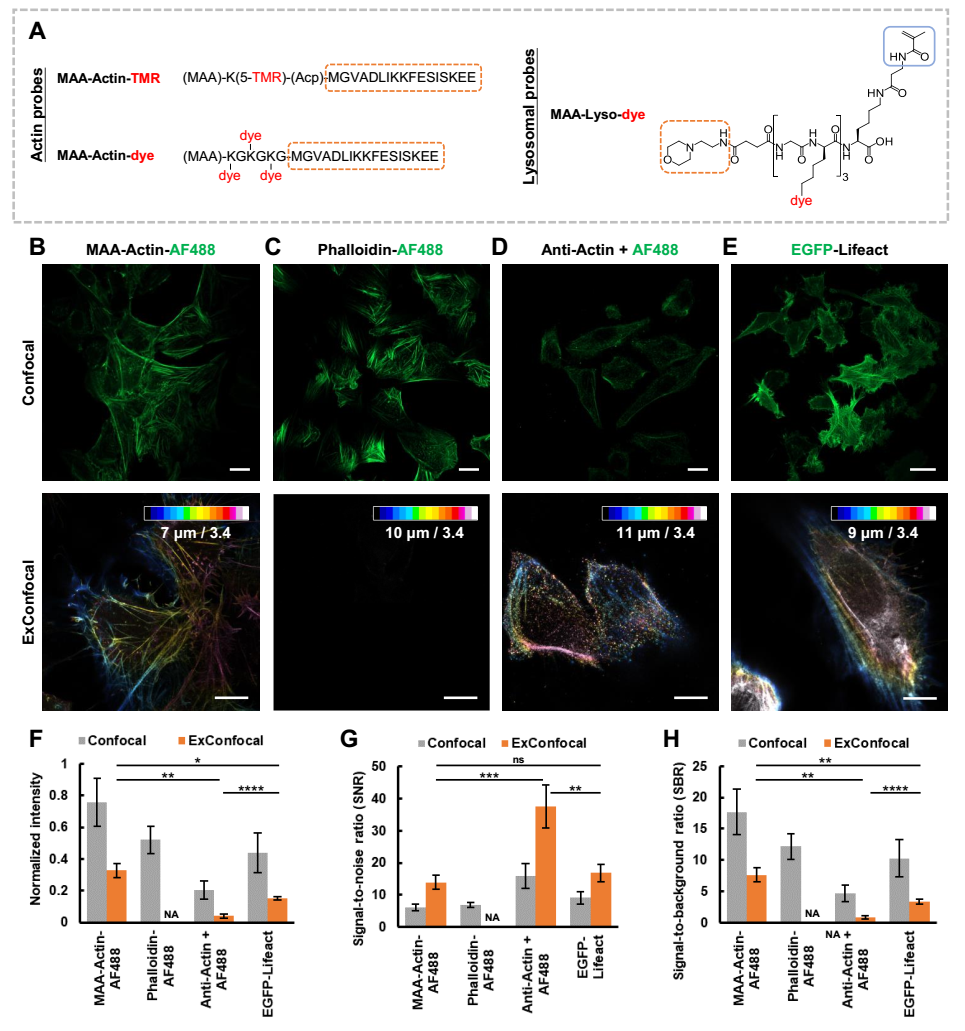
图1 探针设计及其与其他标记方法在膨胀显微术中的性质对比
首先,针对ExM对样品的特殊要求,研究团队设计了一类新的模块化、通用性的SMOP探针构架(图1A)。此类SMOP至少包含四个部分:(1)识别基团,用以特异性结合目标结构;(2)锚定基团,用以共价结合膨胀水凝胶;(3)荧光染料,发出荧光信号;(4)连接基团,用以连接探针其他部分。通过锚定基团的加入,使得SMOP整体在膨胀样品的处理过程中不会从水凝胶网格中脱落,最终保持足够的荧光信号。该模块化的设计还可以灵活选择不同染料,实现对不同策略的超分辨成像的兼容;同理,通过更改识别基团,可实现不同结构的解析。
研究团队对比了多种标记方法在膨胀显微术中的表现(图1B-1H)。传统小分子探针可在样品膨胀前呈现优良的成像质量,但在样品膨胀后会丢失所有荧光信号。抗体标记由于尺寸较大、标记密度较低,在样品膨胀后,荧光信号变得更加不连续。荧光蛋白在膨胀先后均可表现较高的荧光亮度,但由于其表达水平难以控制,会导致较高的胞内背景。而本文所开发的SMOP探针在膨胀前后均可实现微丝样品结构连续的高亮度、高信噪比成像。
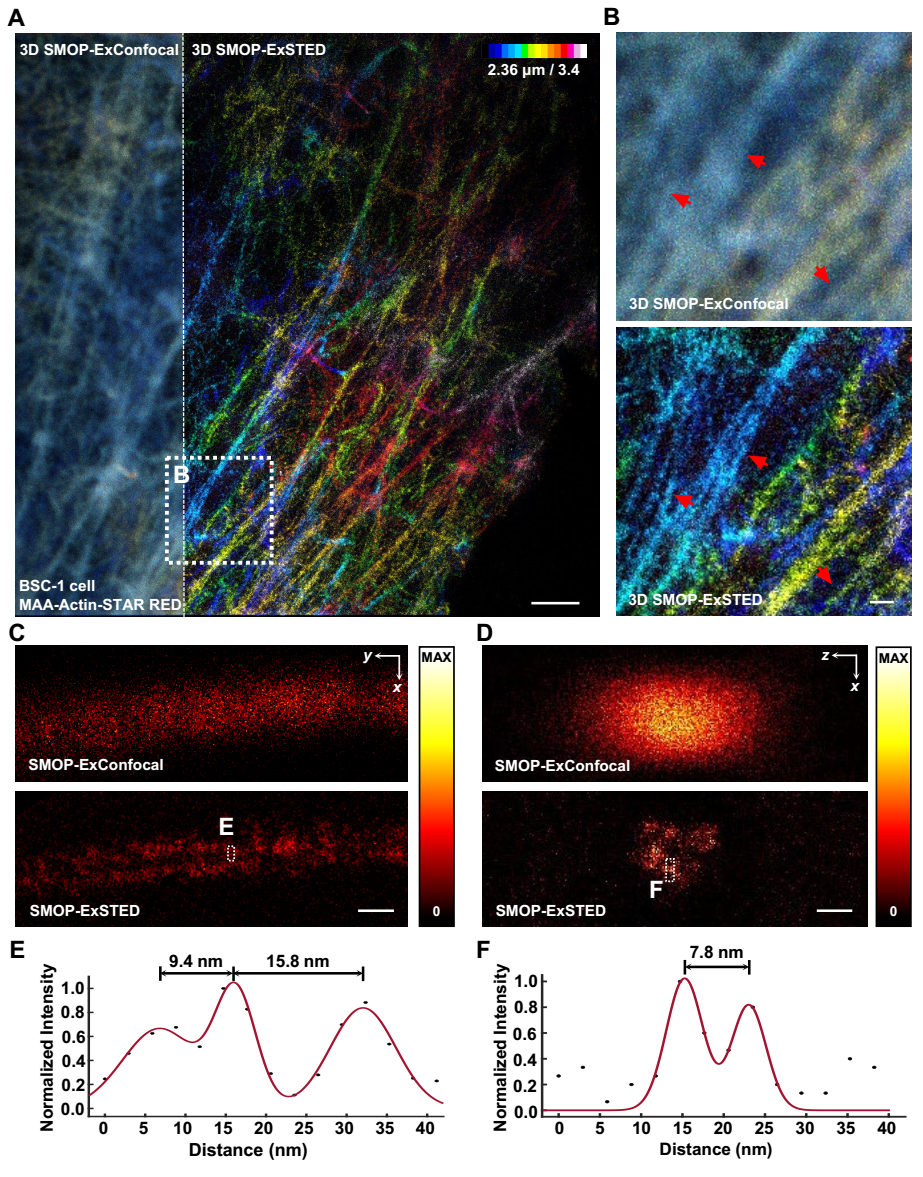
图2 三维分辨率测定
随后,团队将SMOP应用于ExSTED成像中,验证了SMOP在样品膨胀之后依然满足超分辨成像的亮度、抗漂白性能要求,并测定了其三维分辨率(图2)。结果显示,该方法可达到横向约6 nm、轴向约9 nm分辨率,为相应样品的膨胀显微-共聚焦成像结果的17倍以上。
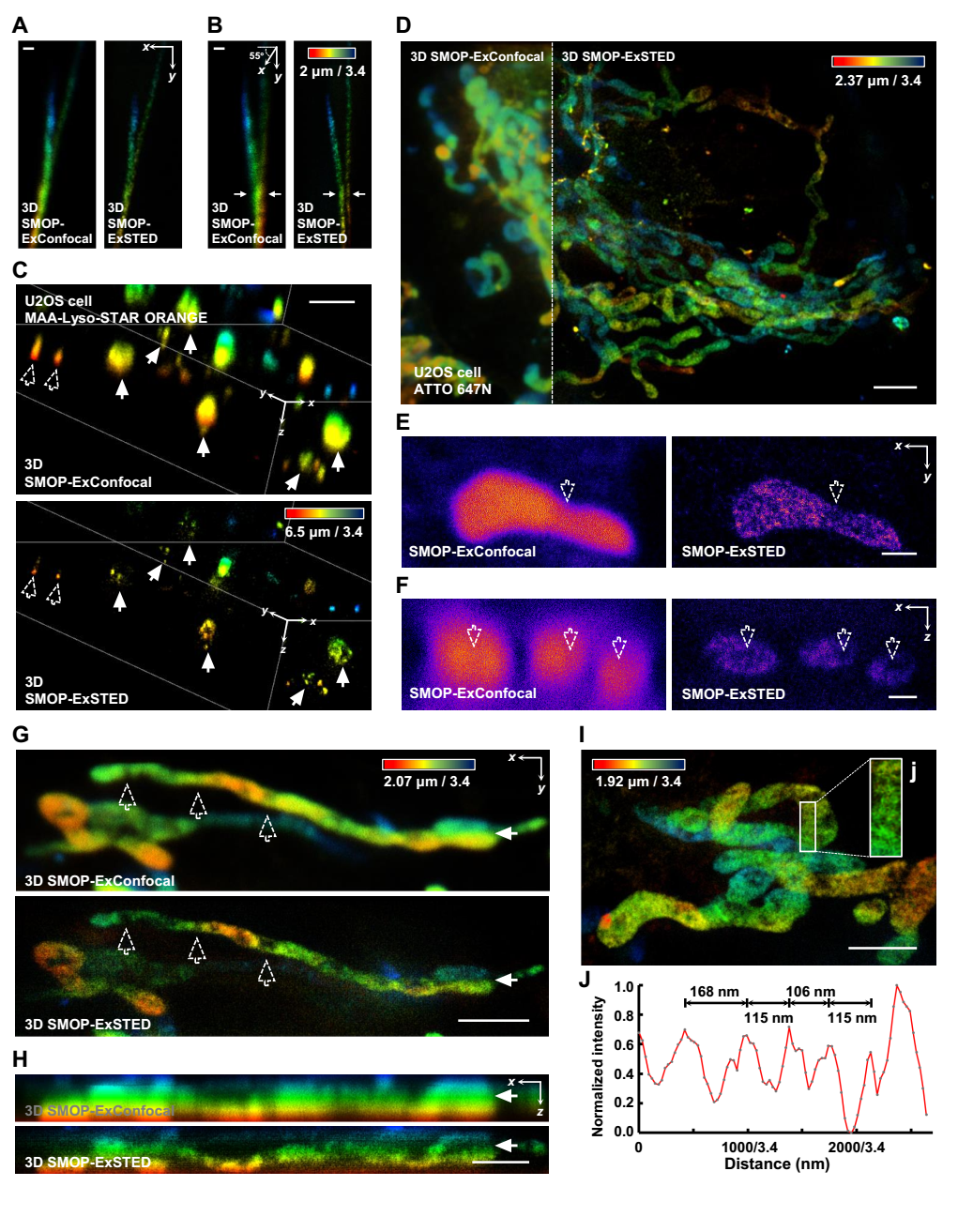
图3 膨胀细胞中的多种亚细胞结构三维重建结果
基于以上结果,团队进一步验证了该方法实现不同亚细胞结构成像的普适性(图3)。在膨胀后的细胞样品中,随着成像深度进一步增加,像差也进一步加剧。团队通过引入自适应光学设置和高数值孔径(numerical aperture, NA)油浸物镜来实现像差的校正和分辨率的提升。
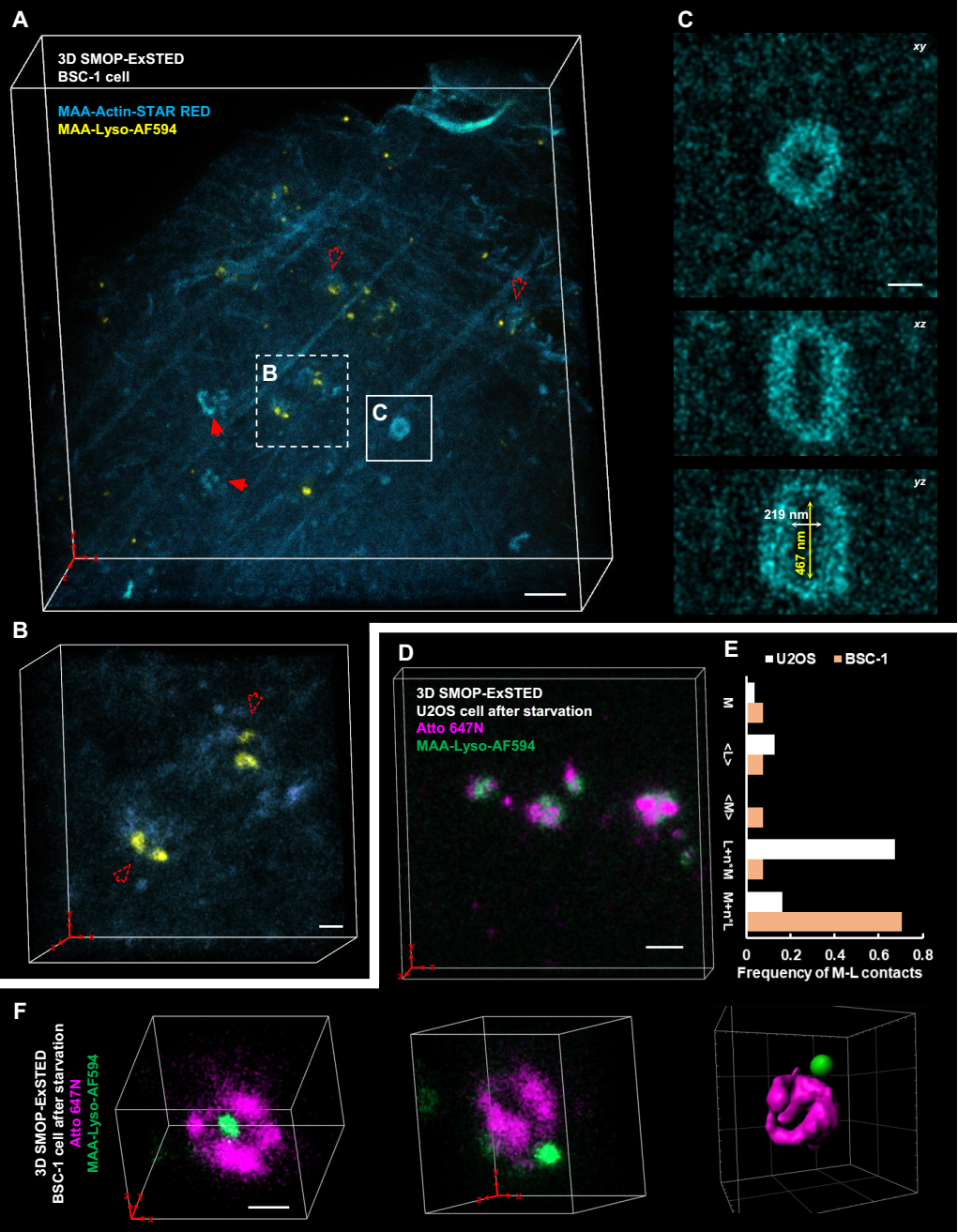
图4 双色SMOP-ExSTED成像
最后,团队在微丝-溶酶体和溶酶体-线粒体互作成像中进一步验证了该方法的多色、三维超分辨成像能力(图4)。
总结与展望
该研究通过光学、生物学、化学、计算机等多学科融合交叉,实现三维多色亚十纳米分辨率的光学超分辨显微成像,为生命科学、医学、药学等领域的研究提供了新的有力工具。
如果你是投资人、创业团队成员或科研工作者,对果壳硬科技组织的闭门会或其它科创服务活动感兴趣,欢迎扫描下方二维码,或在微信公众号后台回复“企业微信”添加我们的活动服务助手,我们将通过该渠道组织活动——