点击左上角“锂电联盟会长”,即可关注!


【研究背景】
锂离子电池(LIB)是便携式电子产品、电动汽车和电网规模储能不可或缺的电源。然而,商业锂离子电池含有高度易燃的液态电解质,这会导致严重的安全隐患,特别是在大型电池中。此外,商业化锂离子电池的能量密度很快就会达到其物理化学极限,因此开发具有高能量密度和更高安全性的下一代储能技术至关重要。全固态电池(ASSB)最近因其本质安全性和理论上的高能量密度而重新引起人们的兴趣。为了实现ASSB技术,首要任务是设计具有快速离子传输行为的超离子导体(又名固态电解质(SE))在室温下。设计SE时,应满足几个基本标准,i)具有高结构耐受性和与移动离子弱相互作用的稳定阴离子框架;(ii)由相关空位和间隙缺陷构建的连续离子传导路径;(iii)离子跳跃的低迁移能垒。遵循这些标准,不同的阴离子框架(即S2-、O2-、BH4-、X-(X=F、Cl、Br、I)已被用来设计具有高室温离子电导率的SE,代表性的是硫化物电解质(即,Li10GeP2S12(12 mS cm-1)、Li9.54Si1.74P1.44S11.7Cl0.3(25 mS cm-1)、氧化物电解质(即Li7La3Zr2O12、Li1.4Al0.4Ti1.6(PO4)3、硼氢化物(即LiBH4、LiI)和卤化物电解质(即Li3YCl6和Li3YBr6)。一些SE已表现出与液态电解质相当的离子电导率。
在所有阴离子化学中,一价卤素阴离子由于其独特的物理化学特性而引起了广泛的研究兴趣,包括大离子半径、长离子键、高极化性、与锂离子的弱相互作用以及高电化学氧化稳定性。受这些特性的启发目前,已开发出许多基于卤素阴离子化学的卤化物电解质,如β-Li3AlF6、Li3InCl6、Li2ZrCl6、Li3ScCl6、SmCl3·0.5LiCl、Li3TiCl6、Li3HoBr6和Li3LaI6这些电解质中,离子传输是通过锂离子跳跃到晶体结构中的空位发生的。通过异价取代增加空位的数量是增强离子电导率的有效方法。然而,锂离子和空位的浓度及其之间的相关性对卤化物电解质整体离子电导率的影响仍不清楚。
【工作简介】
近日,宁波东方理工大学(暂名)孙学良院士、王长虹团队 (原单位:加拿大西安大略大学)联合马里兰大学莫一非教授以及国联汽车动力电池研究院王建涛教授合成了一系列 Li3-xLu1-xZrxCl6 (LLZC, 0
【内容表述】
在通式为Li3MX6(M=三价阳离子,X=卤素阴离子)的卤化物SE中,阳离子始终占据由六个卤素阴离子通过离子键配位的八面体位点。所有锂离子都通过由以下组成的三维传导网络扩散:共享面或四面体连接的八面体。卤素阴离子框架中的离子扩散遵循通过空位的离子跳跃机制。为了阐明离子和空位浓度对卤化物SE离子电导率的影响,特意设计了三种场景同一阴离子骨架中不同的离子和空位浓度(图1):(1)当锂离子含量大于氯离子骨架中的空位含量时,可用于锂离子跳跃的空位是有限的。因此,离子电导率受到低空位浓度的限制(图1a和1b)。(2)当锂离子含量小于空位含量时,可用于离子传输的移动锂离子受到限制。因此,离子电导率受到低可移动锂离子浓度的限制(图1e和1f)。(3)当锂离子含量等于空位含量时,离子传输最有效,从而显示出最佳的离子电导率(图1c和1d)。为此,选择Li3-xLu1-xZrxCl6(0
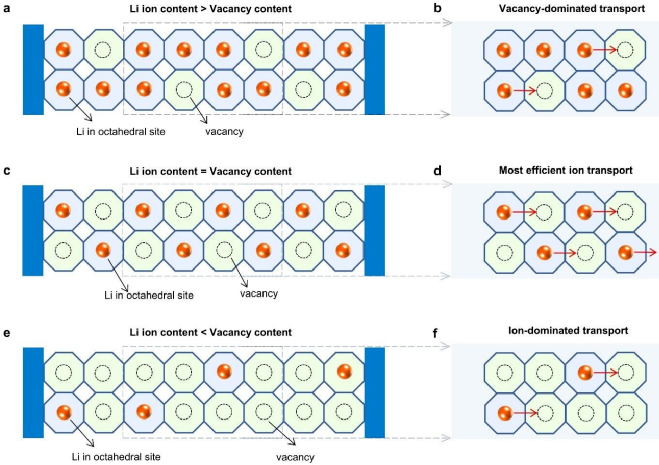 图1. 锂离子和空位浓度相关的不同输运情况。(a,b)当亚晶格中的离子含量大于空位含量时,亚晶格显示出空位主导传输。(c、d)当亚晶格中离子含量等于空位含量时,离子传输效率最高。(e、f)当离子含量低于空位含量时,它遵循离子主导传输机制。因此,低离子浓度会导致低离子传导率。
图1. 锂离子和空位浓度相关的不同输运情况。(a,b)当亚晶格中的离子含量大于空位含量时,亚晶格显示出空位主导传输。(c、d)当亚晶格中离子含量等于空位含量时,离子传输效率最高。(e、f)当离子含量低于空位含量时,它遵循离子主导传输机制。因此,低离子浓度会导致低离子传导率。
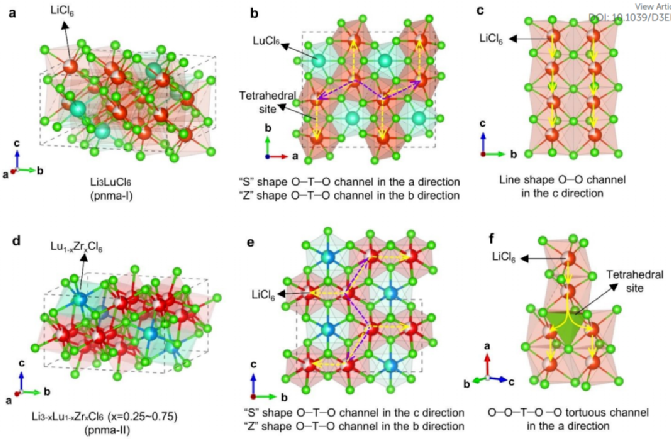
图2. Li-Lu-Zr-Cl 固溶体的结构分析。(a) Li3LuCl6 的晶体结构。(b) 沿 a 和 b 方向的离子传导路径。(c) 沿 c 方向的离子传导路径。(c) Li3-xLu1-xZrxCl6 (x=0.25~0.75)的晶体结构。(e) 离子在 b 和 c 方向的传导路径。(f) 沿 a 方向的离子传导路径。
Li-Lu-Zr-Cl固溶体的结构分析:进行高分辨率X射线衍射(XRD)以了解Li3LuCl6基体中Zr取代的结构变化。高分辨率图案被精修。晶胞体积和晶格参数在0.25至0.75范围内的线性关系表明Li-Lu-Zr-Cl固溶体的形成。Li3LuCl6矩阵具有pnma空间群的正交结构(图2a),这与之前使用具有三方结构(空间群p-3m1)的矩阵(例如Li3YCl6、Li3ErCl6、Li3YbCl6)的工作不同。与Zr-掺杂后,Li3-xLu1-xZrxCl6(0.25x0.75)固溶体仍保持空间群(pnma)的斜方晶系框架(图2d)。然而,MCl6八面体变得倾斜,并且阳离子重新排列,正如g(r)分析所证实的。
由于阳离子重排,Li3-xLu1-xZrxCl6固溶体中的离子传输途径也发生了变化。如图2b所示,具有pnma-I结构的Li3LuCl6在a方向上具有“S”形的八-四-八(O-T-O)传导通路,在b方向上具有“Z”形的O-T-O传导通路。在c方向上,Li3LuCl6具有线性八至八(O-O)传导路径(图2c)。相比之下,pnma-II结构的Li3-xLu1-xZrxCl6固溶体在c方向上具有“S”形O-T-O离子路径,在b方向上具有“Z”形O-T-O传导(图2e)。然而,由于引入了堆垛层错,Li3-xLu1-xZrxCl6在一个方向上具有曲折的O-O-T-O-T传导路径(图2f)。根据之前的理论计算,O-T-O传导通道比阴离子亚晶格中的O-O传导通道具有更高的能垒。。因此,这种结构变化不能解释离子电导率的提高。此外,在Li-Lu-Zr-Cl固溶体中,阳离子阻挡效应应该更加突出,因为四价Zr4+具有比三价Lu3+更显著的库仑排斥力,这阻止了锂离子通过MCl6八面体周围的四面体位点传输,因此,从pnma-I到pnma-II的结构变化不能完全解释Zr掺杂Li3MCl6固溶体离子电导率的提高。其他决定性因素,例如结构中的锂离子和空位浓度,也应该考虑和仔细研究,因为根据阿伦尼乌斯-爱因斯坦方程,它们本质上影响离子电导率。
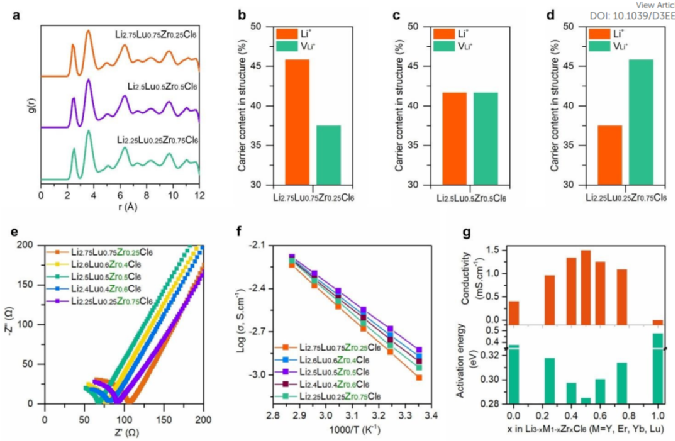
图3. Li3-xLu1-xZrxCl6 (LLZC) 固溶体中锂离子和空位含量的定制及其电化学特性。(a) pnma-II 子晶格在不同 Zr 取代度下无移动离子的径向分布函数 g(r)。(b) Li2.75Lu0.75Zr0.25Cl6,(c) Li2.5Lu0.5Zr0.5Cl6,(c) Li2.75Lu0.75Zr0.25Cl6。(e) LLZC 固溶体在室温下的 EIS 曲线。(f) LLZC 固溶体的阿伦尼乌斯图。(g) LLZC 的化学成分与相应的室温离子电导率和活化能之间的关系。
hcp阴离子亚晶格中空位浓度的影响:高分辨率XRD结果证实,当Zr取代度从0.25增加到0.75时,Li-Lu-Zr-Cl固溶体不会发生结构变化。此外,没有移动离子的骨架子晶格的径向分布函数g(r)在不同的Zr取代下保持相同(图3a),证实晶体结构保持相同。
通过用Lu异价锆取代(Zr4+,72pm),可以降低氯化物亚晶格中的锂离子含量,同时可以增加空位含量。当25%的Zr4+替代Lu3+时,空位含量增加到37.5%(图3b)。当一半的Lu3+被Zr4+取代时,锂离子浓度和空位含量达到平衡(图3c)。进一步的异价取代逆转了锂离子和空位之间的关系(图3d)。图3e显示了Li-Lu-Zr-Cl固溶体在室温(RT)下的电化学阻抗谱(EIS)曲线。Li3LuCl6在室温下的离子电导率为0.40 mS cm-1。当Zr取代25%时,离子电导率增加至0.96 mS cm-1。当Zr取代量为50%时,离子电导率跃升至1.50 mS cm-1,电子电导率低至6.75×1010S.cm-1。进一步增加Zr含量至75%,离子电导率降低至1.12 mS cm-1。为了确定活化能,测量了与温度相关的EIS。图2f显示了Li3-xLu1-xZrxCl6(x=0,0.25,0.5,0.75)固溶体的阿伦尼乌斯图。室温离子电导率和相应的活化能如图3g。事实上,Li2.5Lu0.5Zr0.5Cl6表现出最高的离子电导率(1.50 mS cm-1)和最低的活化能(0.285eV),其中阴离子亚晶格中的Li空位和锂离子含量相当。不仅是案例,还有其他固溶体(例如,Li-Y-Zr-Cl、Li-Er-Zr-Cl、Li-Yb-Zr-Cl、Li-Yb-Hf-Cl、Li-Zr-In-Cl),当离子和空位含量平衡时也显示出最高的离子电导率,这意味着平衡锂离子和空位含量对于获得最佳离子电导率至关重要。此外,对Li3-xLu1-xZrxCl6(x=0.25、0.5、0.75)进行了AMID模拟。模拟结果证实,与Li2.25Lu0.25Zr0.75Cl6(0.23±0.02eV)和Li2.75Lu0.75Zr0.25Cl6(0.30±0.03eV)相比,Li2.5Lu0.5Zr0.5Cl6显示出最高的锂离子电导率和最低的活化能(0.20±0.02eV)。实验结果和理论计算一致表明,平衡锂离子和空位浓度对于在六方最密堆积(hcp)阴离子亚晶格中获得最高离子电导率起着至关重要的作用。
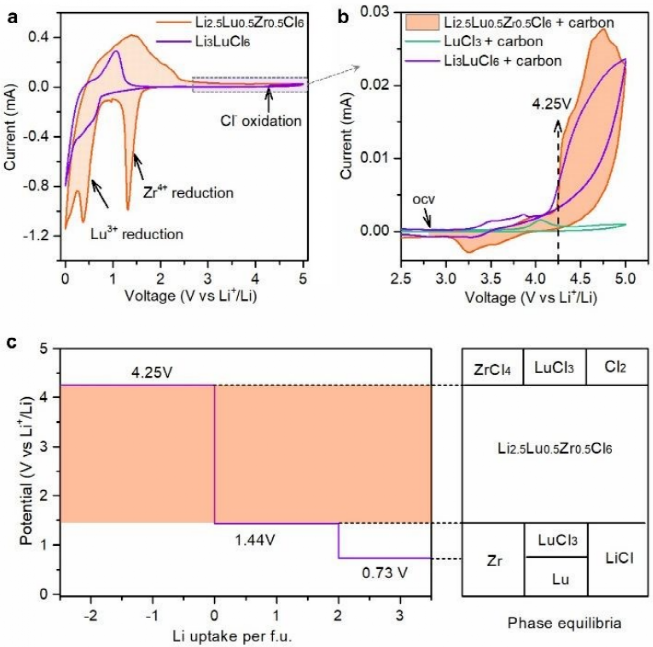
图4. Li2.5Lu0.5Zr0.5Cl6 的本征电化学窗口。(a) Li2.5Lu0.5Zr0.5Cl6 和 Li3LuCl6 的 CV 曲线。(b) 从开路电压(ocv)到 5V 的 CV 曲线放大区域。(c) Li2.5Lu0.5Zr0.5Cl6 的电压曲线和相平衡的第一性原理计算结果。
电化学窗口:为了进一步了解卤化物SE的固有电化学窗口,对含20%碳的Li2.5Lu0.5Zr0.5Cl6进行循环伏安法(CV),它提供了足够的电子传导途径(图4a)。Li2.5Lu0.5Zr0.5Cl6在氧化扫描过程中非常稳定。只有当放大CV曲线时,才能看到Li2.5Lu0.5Zr0.5Cl6在4.25V时轻微氧化(图4b)。高氧化稳定性有利于高压ASSB的循环稳定性。还观察到4.0V左右的小肩峰,可能源自前体(LuCl3)的一些杂质。与Li3LuCl6相比,异价取代(例如Zr4+、Hf4+)增强了卤化物SE的氧化稳定性,但牺牲了其还原稳定性,在1.75V(相对于Li+/Li)和0.7V(相对于Li+/Li)有两个峰在还原扫描期间检测到。根据第一原理计算(图4c),1.75V峰值归因于Zr4+还原,0.7V峰值与Lu3+还原有关。
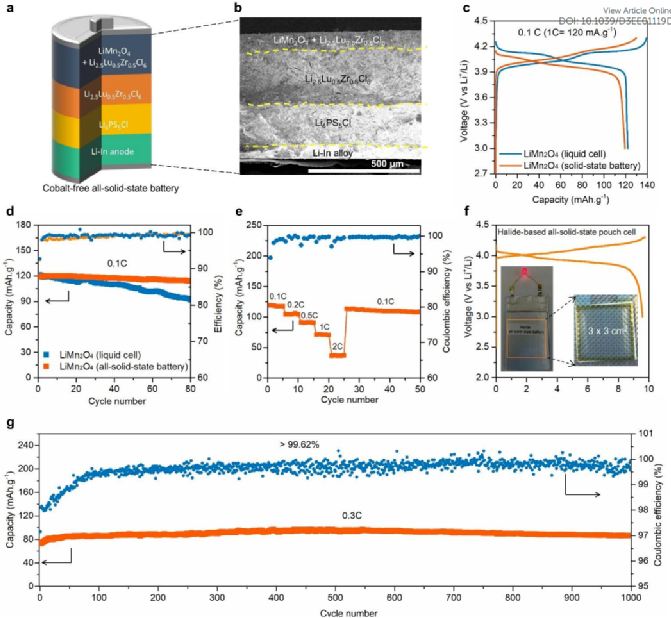
图5. 采用 LiMn2O4/LLZC/Li6PS5Cl/Li-In 配置的无钴全固态电池的电化学性能。(a) 以 LiMn2O4 为阴极的卤化物全固态电池示意图。(b) ASSB 截面的扫描电镜图像。(c) 与全固态电池相比,液态电池中锰酸锂的初始充放电曲线。(c) 0.1C 下的循环稳定性。(e)速率性能。(f) 采用锰酸锂阴极的卤化物全固态软包电池的充放电曲线。(g) 在 0.3 C、150 MPa高压条件下的长期循环稳定性。
无钴全固态电池的电化学性能:尖晶石LiMn2O4由于其输出电压高、成本低、储量丰富、环境亲和性好、离子扩散动力学良好、热稳定性优于其他材料而被认为是最有前景的正极材料之一。尽管如此,LiMn2O4正极受到的关注少于ASSB配置中的层状正极。根据理解,使用卤化物电解质开发无钴LiMn2O4基ASSB有几个优点。首先,LiMn2O4具有三维锂离子传输通道,这有利于在ASSB中获得高倍率性能。其次,LiMn2O4的电压范围为3.0至4.3V,与Li2.5Lu0.5Zr0.5Cl6的电化学稳定性窗口完全兼容。第三,LiMn2O4在液态电池中会遭受锰溶解问题,而在固态中可以完全避免这种情况。
由于这些原因,用固态卤化物电解质Li2.5Lu0.5Zr0.5Cl6构建了基于LiMn2O4的ASSB(图5a)。图5b显示了LiMn2O4基ASSB的横截面结构的SEM图像。图5c比较了LiMn2O4在液态电池和ASSB中在0.1C(1C=120 mA g-1)下的初始充放电曲线。ASSB中的LiMn2O4显示出119.4 mAh g-1的高初始容量,0.1C时库仑效率高达91.8%。ASSB中LiMn2O4的高利用率表明LiMn2O4与Li2.5Lu0.5Zr0.5Cl6接触良好,横截面ASSB的扫描电子显微镜(SEM)图像及其元素图证实了这一点。图5d比较了LiMn2O4在ASSB和液态电池中的循环稳定性。在液态电池中,放电容量衰减非常快,这很可能是由于锰的溶解和Jahn-Teller效应引起的结构变化所致。相反,LiMn2O4基ASSB在0.1C下表现出稳定的循环稳定性。80次循环后的容量保持率高达94.2%,表明ASSB配置可以避免Mn溶解的问题。X射线光电子能谱(XPS)进一步证实ASSB中Mn的溶解被阻止。图5e展示了ASSB的倍率性能。2C时的比容量为42 mAh g-1。良好的倍率性能源于LiMn2O4的三维锂离子传输通道和Li2.5Lu0.5Zr0.5Cl6的高离子电导率。此外,通过干膜工艺制备了尺寸为3×3 cm2的卤化物基全固态软包电池(图5f)。该全固态软包电池的容量为9.58 mAh g-1,库伦效率高98.4%,优异的循环稳定性,并能成功点亮LED灯泡和电风扇。为了评估长循环稳定性,还在0.3C下测试了ASSB(图5g),结果表明,在0.3C下循环时,容量约为98 mAh g-1,并且在1000次循环后没有容量衰减,这归因于Li2.5Lu0.5Zr0.5Cl6和LiMn2O4之间具有良好的界面化学和电化学相容性。在最初的90个循环中库仑效率的上升趋势(图5g)归因于界面的稳定和施加大外部压力(150MPa)导致的内应力的减轻。这些结果首次对ASSB中的无钴和低成本LiMn2O4正极进行了全面评估,特别是通过采用固态卤化物电解质。
综上所述,作者合成了一系列 Li3-xLu1-xZrxCl6 (0
【文献详情】
C. Wang, S. Wang, X. Liu, Y. Wu, R. Yu, H. Duan, J. T. Kim, H. Huang, J. Wang, Y. Mo and X. Sun, Energy Environ. Sci., 2023, DOI: 10.1039/D3EE01119D.
【作者简介】
孙学良教授,中国工程院外籍院士,加拿大皇家科学院院士和加拿大工程院院士,现任宁波东方理工大学(暂名)讲席教授,物质与能源研究院院长。曾任加拿大西安大略大学杰出教授,加拿大纳米能源材料领域首席科学家。1999年获得英国曼彻斯特大学博士学位。现任国际能源科学院(IOAEES)副主席及Springer旗下Electrochemical Energy Review(IF=32)期刊主编。目前重点从事固态电池、锂离子电池和燃料电池的基础应用研究,已发表SCI论文620余篇,其中包括Nat. Energy, Nat. Commun., Sci. Adv., Joule, Matter, J. Am. Chem. Soc., Angew. Chem., Energy Environ. Sci., Adv. Mater.等杂志。论文总引用为60000余次,H-index=128。申请核心专利技术56件(其中26项已授权)。曾获得加拿大西安大略省青年科学家研究奖、加拿大国家资深首席科学家、加拿大西安大略大学工程院学术奖研究成就奖、加拿大多元文化学会职业成就奖、加拿大化学学会材料化学研究成就奖、加拿大加华专业联会教育基金奖、加拿大西安大略大学最高研究成就奖和杰出教授奖、国际电池学会电池技术奖等奖项。
王长虹博士,现为宁波东方理工大学(暂名)Tenure-Track助理教授,副研究员,独立PI,博士生导师。2020年1月获得加拿大西安大略大学博士学位(指导老师: 孙学良院士),2014年获得中国科学技术大学硕士学位,2012-2014年为中国科学院苏州纳米所联合培养研究生(指导老师:陈立桅教授); 目前主要从事全固态电池的关键材料与关键技术的基础应用研究。截止目前已发表SCI论文86篇,以第一(或共一)和通讯作者身份发表SCI论文32篇,其中包括Science Advances(2), Nature Communications,Joule, Matter, Energy & Environmental Science(2), Advanced Materials(2), Angew. Chem. Int. Ed.(2), Advance Energy Materials(2), Advanced Functional Material,Nano Letters(2),ACS Energy Letters等国际权威期刊论文。论文总引用以超过7000余次,个人H-index=45。申请中国及国际专利10余件(授权6件)。曾荣获加拿大最顶级的班廷博士后奖(Banting Postdoctoral Fellowship), MITACS Accelerate Scholarship,2020年国家优秀自费留学奖学金等多项荣誉。
【长期招聘】
因发展需要,宁波东方理工大学(暂名)孙学良院士团队长期招聘优质的博士后、博士研究生、锂电池工艺工程师等,具体如下:
(1)博士研究生:博士研究生是由东方理工与上海交通大学(1+3)和香港理工大学(2+2)联合培养,毕业后授予上海交通大学博士学位和香港理工大学博士学位。博士生在东方理工开展研究工作期间,提供有竞争力的助研津贴; 在香港学习期间,提供与香港理工的博士生同等助研津贴;
(2)博士后:年薪40-60万,缴纳五险一金,在站期间可向地方政府申请最高不超过20万元的科研经费资助;出站后留甬工作,可享受最高不超过60万元的补贴。授予中国科学技术大学博士后证书;
(3)科研助理:优秀者推荐转博,或推荐至其他合作的课题组继续深造;
(4)锂电工程师、研究员:具体详谈。
我们会提供具有国际竞争力的薪酬福利。具有固态电池、二次电池和燃料电池等研究经验者优先考虑。感兴趣的同学可以将自己的简历发送至邮箱(cwang@eitech.edu.cn)。
来源:能源学人
相关阅读:
锂离子电池制备材料/压力测试!
锂电池自放电测量方法:静态与动态测量法!
软包电池关键工艺问题!
一文搞懂锂离子电池K值!
工艺,研发,机理和专利!软包电池方向重磅汇总资料分享!
揭秘宁德时代CATL超级工厂!
搞懂锂电池阻抗谱(EIS)不容易,这篇综述值得一看!
锂离子电池生产中各种问题汇编!
锂电池循环寿命研究汇总(附60份精品资料免费下载)