
记者 | 郑炳巽
近日,泽璟制药(688266.SH)发布公告,自研的“注射用重组人促甲状腺激素”(rhTSH)III期临床试验达到预设主要终点,主要用于“分化型甲状腺癌患者在甲状腺全切或近全切术后辅助诊断”。
接下来,泽璟制药将为了产品的后续上市,向国家药品监督管理局药品审评中心(CDE)提交Pre-BLA的沟通交流申请。
▌与现有产品具备联用潜力
公告显示,注射用重组人促甲状腺激素(rhTSH)是泽璟制药自主研发的生物大分子药物,该产品激活甲状腺细胞的效应是增加放射碘的摄取,可以扫描检测或者放射碘杀伤甲状腺癌细胞。
据悉,分化型甲状腺癌是甲状腺癌的主要亚型,约占甲状腺癌新发病例数约90%。根据弗若斯特沙利文的分析,分化型甲状腺癌新发病例数已由2016年的19.2万人增长到了2020年的21.0万人,预计到2030年,新发病例数将增长至26.0万人。
泽璟制药指出,随着新发病例数的增加,未来我国针对该疾病的术后辅助诊断、治疗的市场有望进一步扩大。
针对该产品的市场现状,《科创板日报》记者以投资者身份致电泽璟制药董秘办,对方人员透露,“产品能够帮助更准确地查出甲状腺癌,目前国内还没有相关产品上市。国外市场上有此类产品,但没有在国内获批。”
目前在泽璟制药的产品管线中,有一款已上市的产品——多纳非尼,其适应症之一,是2022年8月获批的用于治疗“局部晚期或转移性放射性碘难治性分化型甲状腺癌”。针对多纳非尼和rhTSH在治疗上的关系,上述人员表示,“两个产品具有联用的潜力,一个用于诊断环节,一个用于治疗环节。”
值得一提的是,泽璟制药rhTSH除了用于甲状腺癌辅助诊断之外,另一项针对甲状腺癌辅助治疗的III期临床也在进行之中。上述人员指出,目前国内分化型甲状腺癌术后辅助诊断和治疗药物市场还是空白,如果两个临床都成功并获批,将有望获得这一市场份额。
▌国内已有同类产品报上市
不过,《科创板日报》记者查询发现,早在2022年7月22日,智核生物提交的“重组人促甲状腺素注射液”(SNA001)生物制品许可申请(BLA)已获CDE受理,成为国内首个获得CDE上市申请受理的rhTSH,主要用于分化型甲状腺癌术后的辅助治疗。
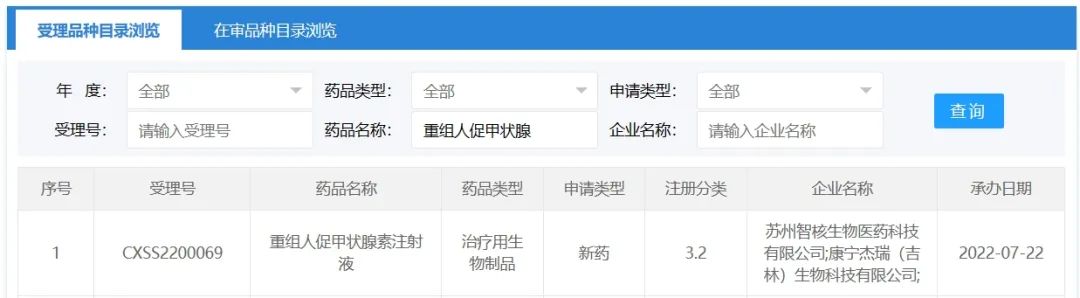
《科创板日报》记者进一步询问泽璟制药上述人员,智核生物获得受理的产品,与公司自家产品有何异同?对方则表示对此不太了解,不好回答。
必须指出的是,泽璟制药rhTSH在后续还需完成与CDE的沟通交流、提交新药上市申请、技术审评、现场核查等多个程序,距离真正获批上市仍有待时日。泽璟制药因此也在公告中提醒,对公司近期业绩不会产生重大影响。
根据2023半年报,泽璟制药当下拥有16个主要在研药品,除已上市的多纳非尼片之外,另有3个在研药品处于新药上市申请、III期或注册临床试验阶段;9个在研药品处于I或II期临床试验阶段;3个在研药品处于临床前研发阶段。
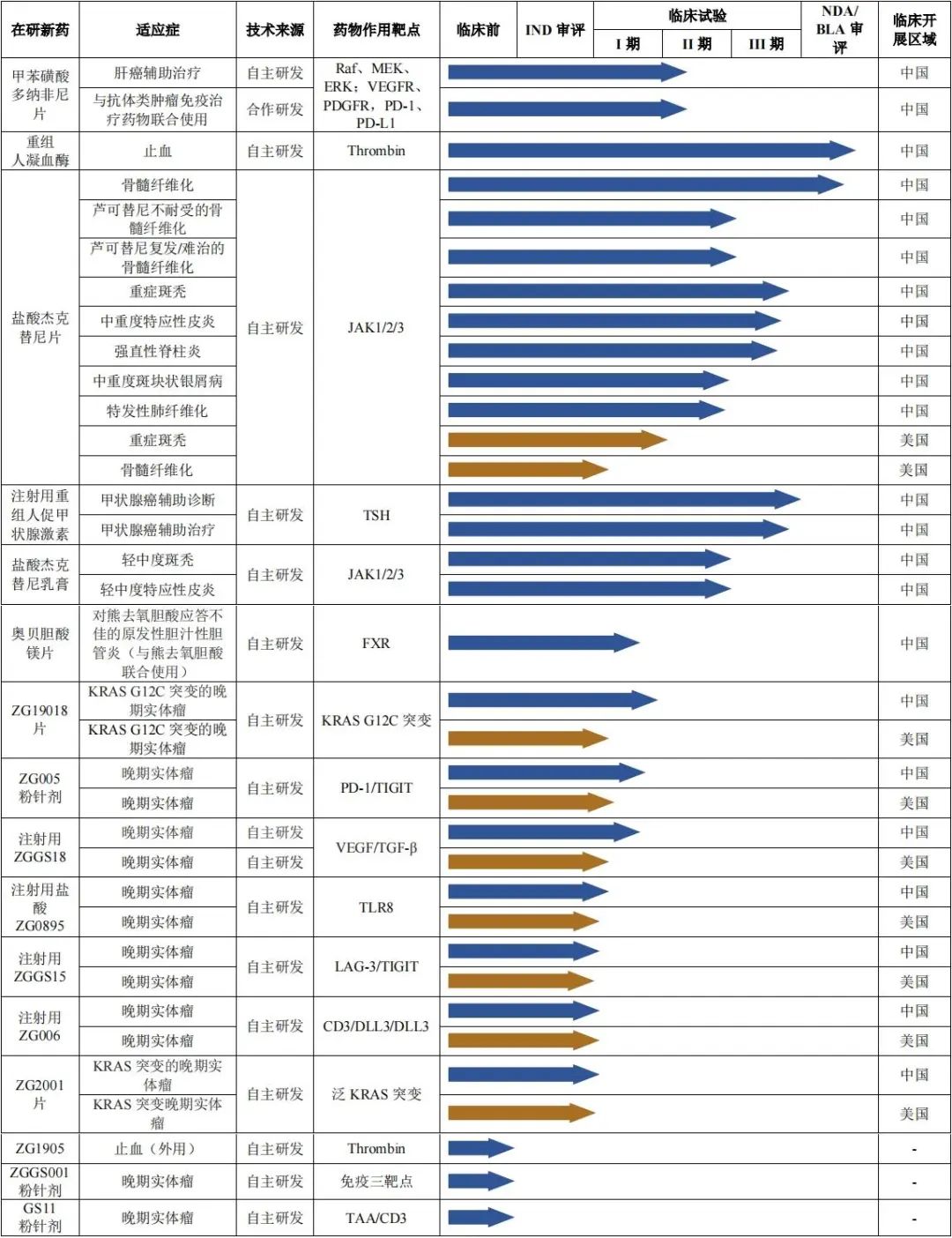
其中,多纳非尼片除前述获批适应症外,还于2021年6月获批用于一线治疗晚期肝细胞癌患者。2021年底,多纳非尼片通过医保谈判,纳入国家医保药品目录。在医保的带动下,多纳非尼市场份额有所扩大,截至2023年6月底,产品已进入833家医院、744家双通道药房。
但是,泽璟制药也透露,由于多纳非尼片上市时间较短,其它产品的研发及上市申请需要较大支出,公司尚未盈利且存在累计未弥补亏损。
2023上半年,泽璟制药实现营收2.199亿元,同比增长108.66%;归母净利润-1.14亿元,去年同期为-2.47亿元;经营活动现金净额为-1.34亿元。同期,泽璟制药研发总投入2.203亿元,占营收比例达100.18%。
推荐阅读







