小分子靶向治疗药物作为一类肿瘤特异性靶点抑制剂,已成为临床癌症治疗的首选。然而,其低生物利用度、耐药性和剂量限制性毒性等缺点限制了靶向治疗效果;此外,其临床治疗和预后评估偏重于检测基因表达水平或观察实体瘤大小的变化,忽视了药物在体内时空性动态变化的监测,导致难以全面评估治疗过程。因此,进一步增强小分子抑制剂的靶向治疗效果,并在时间和空间上动态监测其治疗过程,对癌症的治疗以及预后评估具有重要意义。-
近日,安徽大学生命科学学院唐汝培教授团队在国际著名学术刊物Advanced Functional Materials在线发表了题为“Spatiotemporal Theranostic Nanoprobes Dynamically Monitor Targeted Tumor Therapy” 的论文。2020级博士生方伟为该论文第一作者,唐汝培教授和闫国卿副教授为该论文的共同通讯作者。该研究通过理性整合具有聚集诱导发光(AIE)机制的达沙替尼(DAS)二聚体和非AIE荧光染料吲哚菁绿(ICG),成功构筑了时空动态诊疗纳米探针,并通过胞内定向诱导的AIE猝灭和ICG荧光再增强的动态荧光强度转换,实现了精准的肿瘤诊断、预后评估和药物命运的时空追踪(图1)。

当前,无论何种单一成像机制,由于其在肿瘤部位信号强度保持不变或其转化过程与药物动态变化行为不相关,导致无法准确追踪药物到达肿瘤部位后的命运,如药物是否进入肿瘤细胞,是否被有效释放,以及是否与靶标相互作用等。聚集诱导发射(AIE)和非AIE的传统荧光染料具有完全相反的光致发光机制,将它们合理地整合到纳米级探针中,有望实现肿瘤组织中荧光强度随着药物递送的动态变化。由于纳米探针以聚集体的形式存在,AIE染料的荧光信号强度明显增加,而非AIE染料的荧光信号强度由于聚集而减弱或猝灭(ACQ),最终使得纳米探针的总体荧光强度主要由AIE染料决定。此外,值得注意的是,肿瘤部位纳米探针的特异性快速解聚导致AIE信号的急剧减弱或猝灭可灵敏监测生物靶标周围的药物行为,而水溶性的非AIE染料随着纳米探针的分解而展现的荧光信号再增强可以用于预后评估。
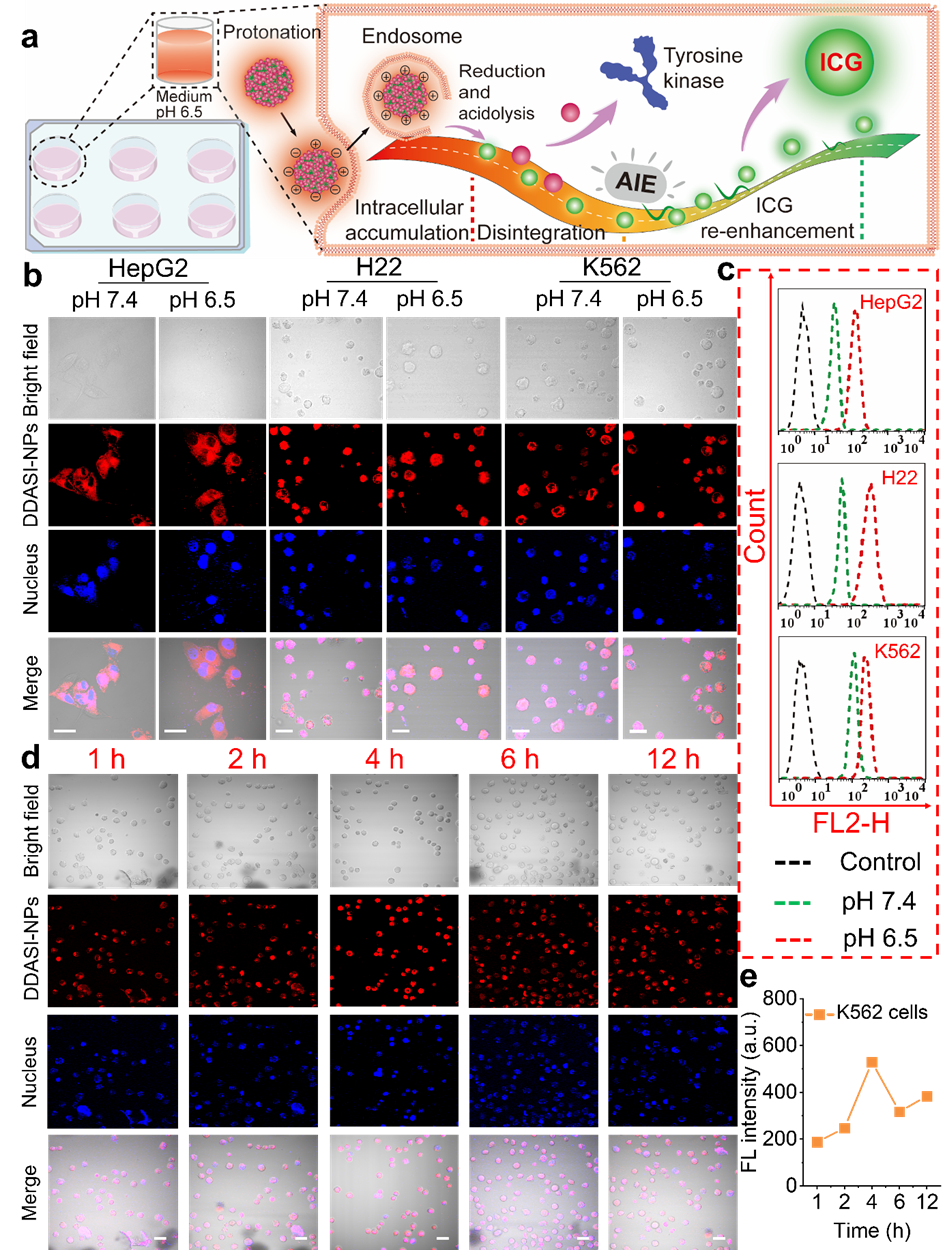
在该研究中,研究人员利用胱氨酸二甲酯对小分子抑制剂达沙替尼(DAS)进行二聚体结构设计,使其产生了与水溶性吲哚菁绿(ICG)相同的近红外发射波长(810 nm),导致纳米探针总体的荧光强度产生加和增强,并且在模拟的肿瘤微环境中表现出定向诱导的先减弱后增强的动态荧光强度转换(图2)。在细胞水平证实该纳米探针在肿瘤胞外通过N杂环质子化和胱氨酸转运体共同增强细胞摄取,并且同样展现出定向诱导的动态荧光强度转换趋势(图3)。另外,纳米探针通过选择性的细胞摄取以及胞内释放,可有效抑制酪氨酸激酶,促进肿瘤细胞凋亡,从而高效抑制肿瘤细胞的增殖(图4)。
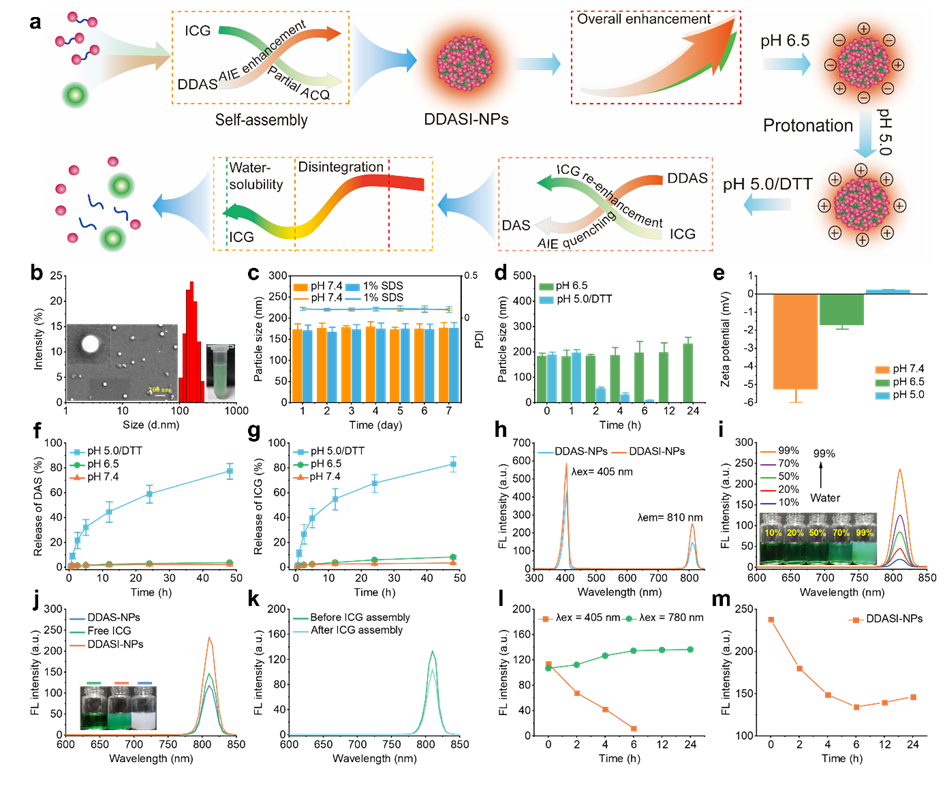 图2 纳米探针在肿瘤微环境中表现出粒径、电位和荧光强度的动态转换
图2 纳米探针在肿瘤微环境中表现出粒径、电位和荧光强度的动态转换

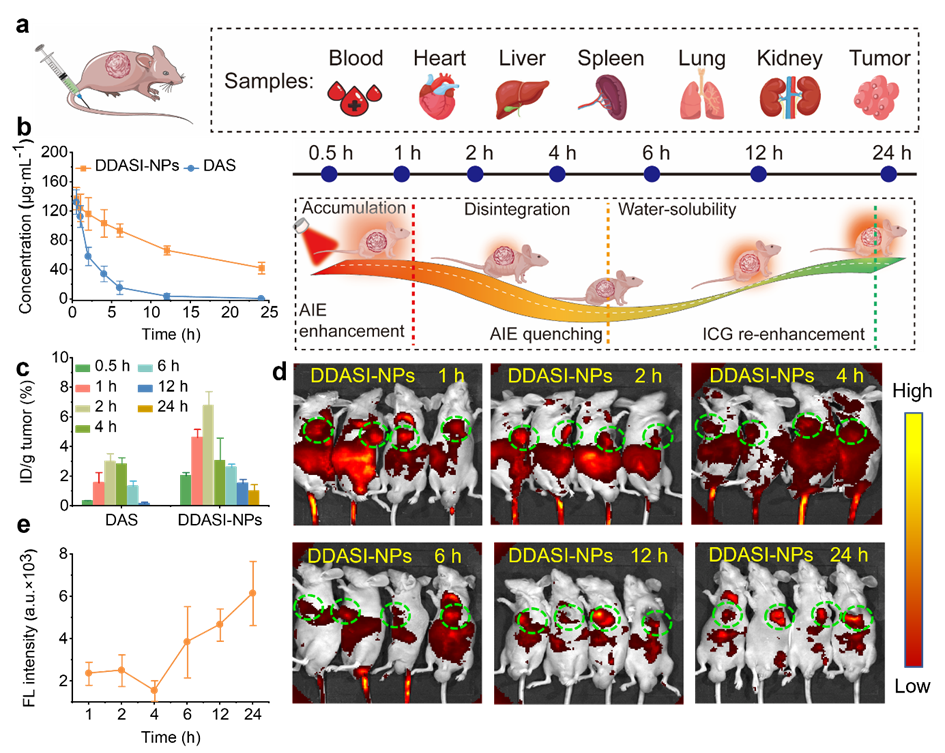
通过建立K562实体瘤模型评估纳米探针的药代动力学、生物分布以及体内动态荧光转换(图5)。结果表明,纳米探针在每个时间点都表现出比DAS更高的血药浓度、更优异的药代动力学特征以及在肿瘤组织中更高的药物含量,表明通过EPR效应、肿瘤胞外质子化和主动细胞摄取显著改善了肿瘤积累。并且,与其他成像策略相比,纳米探针可以通过肿瘤胞内GSH触发的AIE猝灭和ICG的荧光再增强成功地在体内表现出荧光强度的动态变化,从而实现精确的肿瘤诊断和预后评估。此外,体内实验结果也表明,纳米探针可有效抑制肿瘤增长并表现出良好的生物安全性(图6)。

综上所述,研究团队利用肿瘤微环境特异响应的DAS二聚体与ICG自组装,成功构建时空诊疗一体化纳米探针,不仅提高了靶向治疗的精度,而且可对药物治疗过程进行全景式跟踪。该研究工作充分显示了其在生物医学领域的基础研究价值和潜在临床应用前景。





