点击左上角“锂电联盟会长”,即可关注!

一、研究背景
锂金属负极(LMA)的入场有望突破商用锂离子电池(LIB)的理论能量密度瓶颈,迎合动力电池的快速发展对更高能量锂电池的需求。然而,传统电解液分解产生的有机-无机固态电解质中间相(SEI)在锂负极工作期间不稳定,导致SEI破碎、锂枝晶生长和死锂形成,伴生的低库仑效率和安全问题极大限制了锂负极的应用。
近年来,SEI关键组分LiF的确认和机理研究推动了研究人员从多功能添加剂、溶剂改性、锂盐组合和浓度优化等方面着手设计电解液,原位构筑高效的富LiF的SEI。其中,一系列全氟电解液(AFE)、高浓电解液(HCE)和局域高浓电解液(LHCE)凭借超过99%的锂金属库伦效率和高压正极兼容性脱颖而出。尽管成绩斐然,但是高氟含量所加重的经济成本和环境负担没有得到足够的重视。那有没有可能设计一种环境友好且低成本的低氟浓度电解液,兼具良好的锂金属负极和高压正极兼容性来加快锂金属电池(LMB)的商业化过程呢?
二、内容简介
基于有机化学和理论计算的指导,本工作提出了一种溶剂的Si-O键强化策略,用Si-O键替代C-O键,可以提高溶剂的氧化还原稳定性。以二甲基二甲氧基硅烷(DMMS)为代表,仅在1.5M双氟磺酰胺锂(LiFSI)的低盐浓度下,就可实现99.4%的全脱全镀高锂金属库伦效率和>5V的电化学稳定窗口。1.5 M LiFSI DMMS电解液使NCM811(2.3 mAh cm-2)||Li(20 μm)纽扣电池在300次循环后保持80%的容量,高压LCO(3 mAh cm-2)||Li(20 μm)纽扣电池在200次循环后保持96%的容量。采用少量1.5 M LiFSI DMMS电解液(<2.5 g Ah-1)的1.4 Ah NCM811(3.6 mAh cm-2)||Li(20 μm)软包电池,在140次循环后也实现了96%的高容量保持率。相关成果以“Eco-friendly electrolytes via robust bond design for high-energy Li-metal batteries”为题发表在Energy & Environmental Science上。论文第一作者为浙江大学黄一强硕士研究生、浙江大学李如宏博士和中科院物理所翁素婷博士研究生,通讯作者为浙江大学范修林研究员和中科院物理所王雪锋研究员。本文还得到了陈立新教授和范利武研究员的大力支持。
三、核心内容
1. 溶剂设计原则
酯类、砜类和腈类等具有不错抗氧化性(但具有明显还原倾向),这是由于这几种溶剂都具有邻近共轭结构的电子给体部分(Li+受体位点)。与锂金属兼容性好的醚类溶剂由于不含此类共轭结构,抗氧化能力很差。这些现象可以通过分子轨道理论来解释:碳酸酯的羟基氧的孤对电子可以进一步与π*C=O 反键轨道共轭,形成较低能量的填充轨道,这意味着更难失去电子(图 1b)。醚很容易被氧化,是因为没有相位匹配和能量相近的空轨道可以稳定氧的孤对电子。共轭后重组的轨道表现出亲本轨道的混合特征,从这一指导原则出发,利用更高能量的Si 3d轨道参与共轭可产生更高能量的空轨道以提高抗还原性,同时保留低能量填充轨道(图 1b)。为了验证这一推论,作者计算了溶剂的分子轨道并进行了定域化处理。结果表明硅氧烷比醚拥有低得多的最高占据分子轨道(HOMO),意味着更好的抗氧化能力(图 S1)。定域化处理的醚HOMO轨道确实聚集在O原子周围,而硅氧烷或者碳酸酯中的HOMO电子云由于共轭效应向中心Si原子和C=O基团极化(图 1c)。根据量子化学原理,键的柔性力常数可用作定性描述键强度的标准。通俗地讲,Si-O键的柔性力常数高于醚和酯中的C-O键意味着更高的化学稳定性。此外,静电势最小值(EPM)以EC < DME < DMC < DOL < DMMS ≈TEOS ≈MTES < DMES的顺序增加(图 1d),这意味着Li+去溶剂化能依次降低,界面动力学改善,溶剂分解概率降低。因此,通过在更稳定的线型醚分子中用Si取代中心碳链,引入Si-O键,得到了新型硅氧烷溶剂,有望实现比醚和酯更好的综合电化学性能。
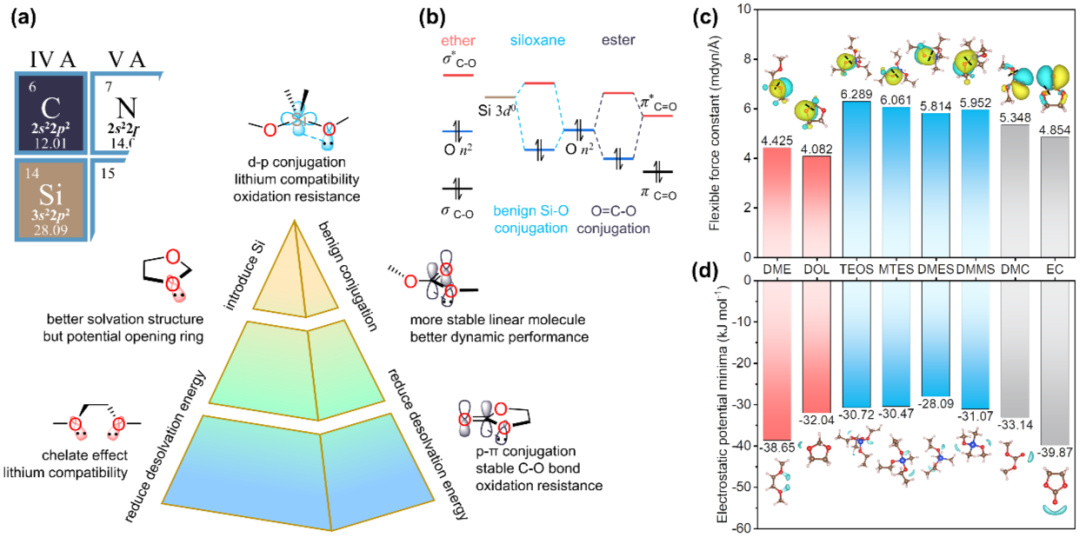
图 1. 溶剂设计原则。(a)溶剂特点分析和设计思路;(b)醚、硅氧烷、酯的部分近似分子轨道示意图;(c)8种溶剂分子中Si-O键或C-O键的化学键弹性力常数和前线分子轨道定域化处理结果;(d)8种溶剂分子静电势极小值。
2. 硅氧烷电解液的电化学性能
为了评估锂金属负极和电解液之间的相容性,作者进行了改进的Li||Cu电池Aurbach测试(图 2a 和表 S5)和全脱全镀测试(图 2b)。其中1.5 M LiFSI DMMS电解液表现最为出色,CE为99.8%(Aurbach测试方法),高于醚基电解液(99.1%)(图 2a)。在低氟含量下实现的高CE为开发环保和实用的LMB电解液提供了一个新的选择(表 S6和图 S5)。由于和锂金属之间的严重副反应,1 M LiPF6 EC/DMC电解液无法通过这种Aurbach测试。对于1.5 M LiFSI DMMS电解液,全脱全镀测试(图 2b和图 S6)的平均CE约为99.4%,并且Li||Li电池稳定循环超过800小时(图 S7)证明了硅氧烷基电解液较好的稳定性。相比之下,由于难以控制的SEI生长和“死”锂生成,碳酸酯电解液在每个电镀/剥离循环中损失约8%的锂。1.5 M LiFSI DME电解液表现稍好,平均CE为~99.0%。氧化电位计算(图 1c)和线性伏安法测试(图 1d)也证明了1.5 M LiFSI DMMS电解液同时具有较好的抗氧化能力。
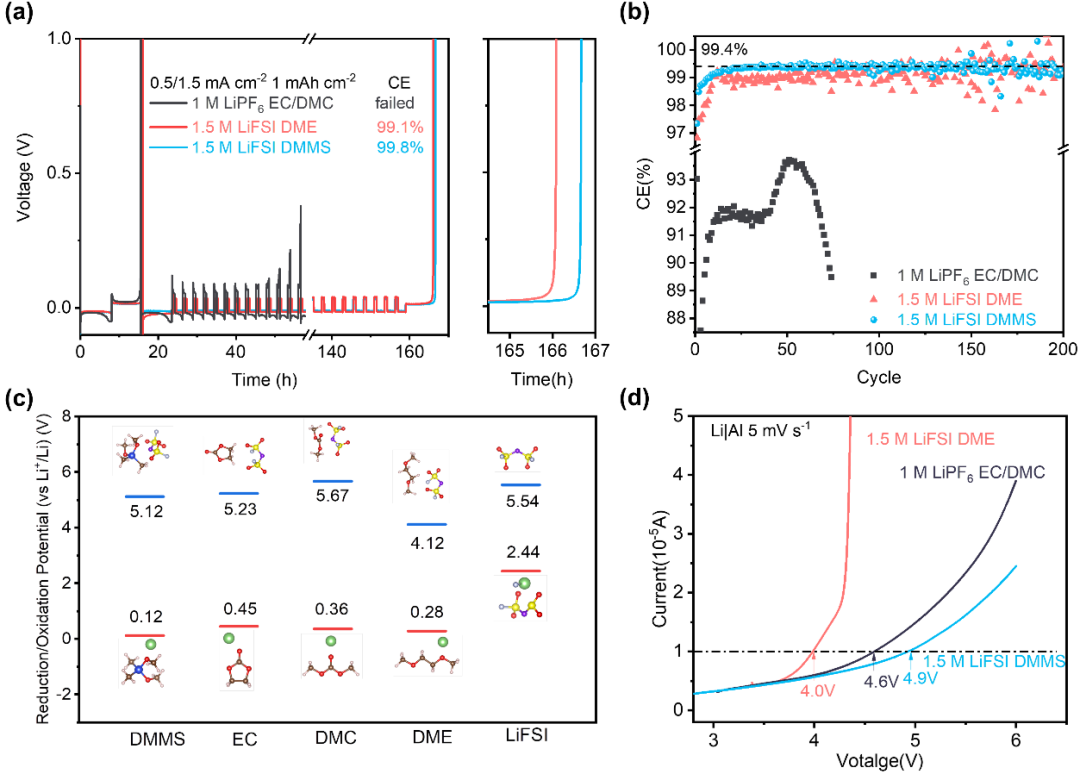
图 2. 电极与硅氧烷电解液之间的电化学相容性。(a),(b),使用不同电解液的Li||Cu半电池的改进Aurbach法测试结果(a)和全脱全镀测试结果(b)。(c),溶剂和LiFSI的理论计算还原和氧化电位。(d),通过线性扫描伏安法(LSV)测试的三种电解质的氧化稳定性结果。
如图3a所示,1.5 M LiFSI DMMS电解液在Li(20 μm)|| NCM811(2.3 mAh cm-2)扣式电池测试中表现出最佳循环性能,350次循环后保持80%的初始放电容量,平均CE约为99.9%(图 3a)。在高载量的3.5 mAh cm-2 NCM811(图S9)和3.0 mAh cm-2 LCO(3~4.5 V,图3e)情况下,1.5 M LiFSI DMMS电解液仍可使电池在200次循环后分别保持88%和96%的容量。如图 3f所示,酯基和醚基电解液在软包电池测试环境下的性能明显劣于之前的扣式电池。而采用1.5 M LiFSI DMMS 的软包电池具有340 Wh kg-1的高能量密度(表 S8),并在140次循环后保持96%的初始容量。硅氧烷电解液还可兼容现行的锂离子电池框架。正如石墨||NCM811软包电池测试所展示的,采用1.5 M LiFSI DMMS电解液的电池在800次循环后实现了~81%的容量保持率,比碳酸酯电解液提高了~40%(图3g)。
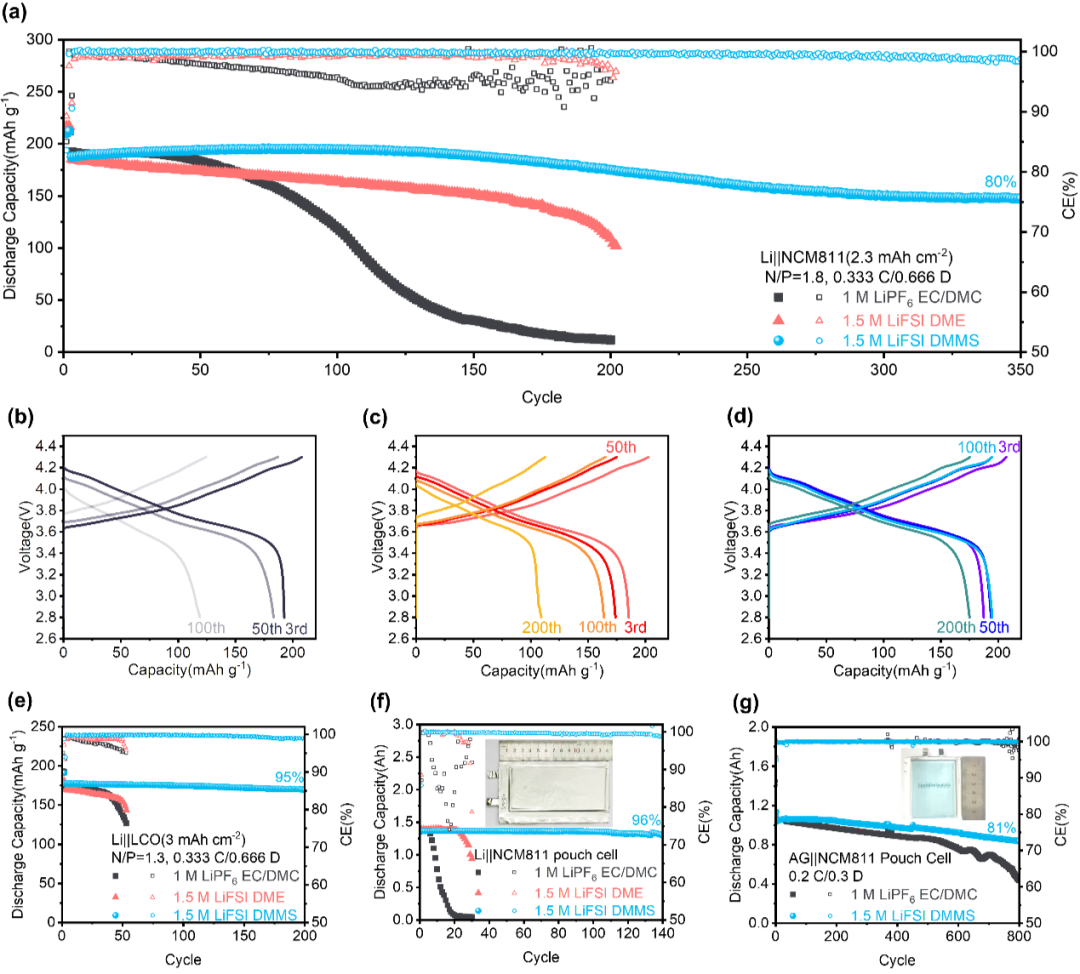
图 3. 锂电池性能。(a),20 μm Li || 2.3 mAh cm-2NCM811电池在0.333 C充电和0.666 C放电(1 C = 200 mAh g-1)下的循环性能。(b-d),使用1 M LiPF6 EC/DMC (1:1, v/v)(b)、1.5 M LiFSI DME(c)和1.5 M LiFSI DMMS(d)的全电池的充放电曲线。(e),20 μm Li ||3 mAh cm-2LCO全电池在0.333 C充电和0.666 C放电(1 C = 180 mAh g-1)下的长循环性能。(f),Li||NCM811软包电池(> 1.4 Ah容量、< 2.5 g Ah-1贫电解液、20 μm薄锂和> 3.6 mAh cm-2高正极负载等)的循环性能。(g),1 M LiPF6 EC/DMC电解液和1.5 M LiFSI DMMS电解液的人造石墨(AG)||NCM811软包电池的长循环性能。
3. 电极界面化学
图 4a-c分别展示了在1 M LiPF6 EC/DMC电解液、1.5 M LiFSI DME电解液和1.5 M LiFSI DMMS电解液中的锂沉积形貌。在 0.5 mA cm-2电流下,由碳酸酯电解液产生的锂金属是直径从20 nm到5 μm的面条状晶须(图 4a)。这种具有高比表面的形态容易加剧与电解液的副反应并诱导“死”锂的形成,导致差的循环性能。1.5 M LiFSI DME电解液改善了镀锂的形态,但锂晶粒之间仍然存在大量空隙(图 4b)。相比之下,1.5 M LiFSI DMMS电解液生成了大晶粒、平整且致密的锂镀层(图 4c),有效缓解了电池中的锂损失问题。
SEI在调节Li+通量和抑制副反应方面发挥着重要作用。X射线光电子能谱(XPS)显示,Ar+蚀刻后,C 1s强度迅速减弱,主要检测到来自盐分解的无机成分,例如LiF(685.5 eV,图 4d)、SOxFy(687.5 eV,图 4d)和Li2S(161.5 eV,图 S22)。先进的冷冻透射电子显微镜(Cryo-TEM)用于揭示在三种电解液中形成的SEI的本征纳米结构(图 4f和图 S23-24)。在碳酸酯电解液中,SEI展现了镶嵌块模型的典型特征,其中大量的Li2O纳米晶随机分布在约60 nm厚的无定型层中(图 S24)。如此厚的SEI表明碳酸酯电解液的分解产物是脆弱和多孔的,导致了严重的副反应和电解液消耗。1.5 M LiFSI DME中SEI薄得多,约为 10 nm(图 S25),具有非晶内层和Li2O规整排列的外层。源自1.5 M LiFSI DMMS的SEI则由附着在锂金属上的大量Li2O和LiF纳米晶组成的无机层(图 S26),和薄的无定型外层(图 4f)组成。两层的总厚度约为10 nm,比DME电解液更均匀。冷冻电子能量损失谱(Cryo-EELS)(图 4g)显示硅氧烷基电解液的SEI富含O和F。然而,作者没有在DME电解液中形成的SEI中检测到F(图 S27)和发现在EC/DMC电解液中形成的SEI中F较少(图 S28)。
从头算分子动力学(AIMD)为新型硅氧烷电解液的SEI化学提供了新的见解(图 4h-l)。计算表明,FSI-通过S-F或N-S键断裂分解(图 4i)。原位形成的碎片(NSO2、N(SO2)2F和SO2F阴离子/自由基等)被进一步还原为热力学稳定的LiF、Li2O、Li2S 和 Li3N等物质(图 4j-k)。通过计算表面Li原子的径向分布函数(RDF),作者对Li与C、O、F和Si的键合情况进行了统计分析(图 4l和图 S29)。随着模拟时间增加,不断增强的Li-F和Li-O峰说明表面Li原子更多地与O和F原子优先键合,这对应着SEI构筑过程中LiF和Li2O的主导地位。
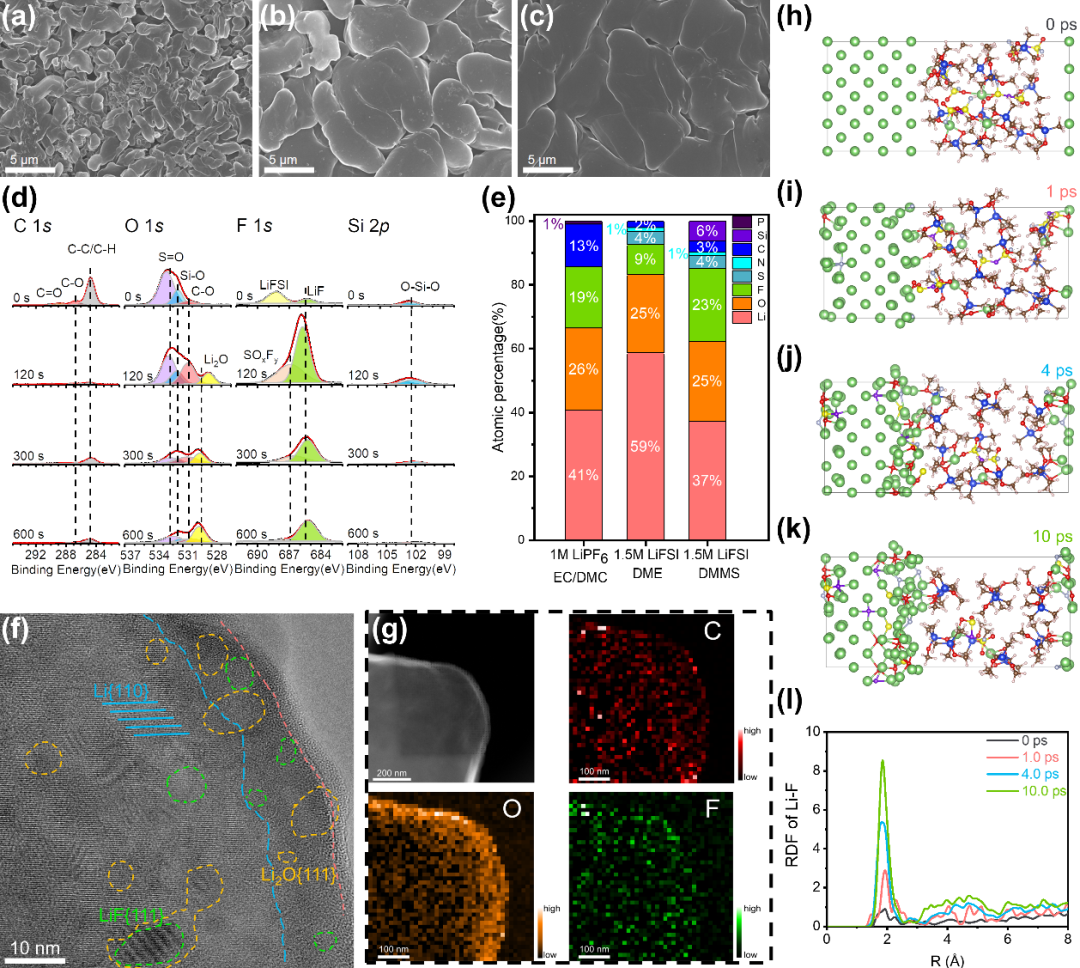
图 4. 负极-电解质界面的表征和AIMD模拟结果。(a-c),1 M LiPF6 EC/DMC(1:1, v/v)电解液(a),1.5 M LiFSI DME电解液(b)和1.5 M LiFSI DMMS电解质(c)中的锂金属沉积形态(0.5 mA cm-2, 2 mAh cm-2)。(d)10个循环后1.5 M LiFSI DMMS中锂金属表面C 1s、O 1s、F 1s和Si 2p 的XPS深度刻蚀。(e),经过120 秒Ar+刻蚀后,在1 M LiPF6 EC/DMC、1.5 M LiFSI DME和1.5 M LiFSI DMMS中循环的锂金属表面检测到的元素的原子百分比。(f),(g),在1.5 M LiFSI DMMS 电解液中新沉积的锂的Cryo-TEM(f)和EELS(g)图像。(h-k),锂-电解液(1.5 M LiFSI DMMS)界面的AIMD模拟照片。(l),Li-F RDF在模拟过程中的演变。
一般通过活性电极测得的电解液的氧化电位更低,是因为新出现的氢转移反应将决定电化学窗口的上限。计算得EC(-225 kJ mol-1)和DME(-269 kJ mol-1)的氢转移反应放能非常大,以至于脱氢反应在低电位下自发进行(图 S31)。DMC和DMMS具有相近的值(分别为-80 kJ mol-1和-72 kJ mol-1),但比EC和DME正得多,这与它们更高的抗氧化能力一致。高分辨率透射电子显微镜(HRTEM)揭示了正极表面降解和电解液分解的程度(图 5e-g)。在1 M LiPF6 EC/DMC中循环的NCM811正极表面,捕获了从层状结构到混合相变化的区域(图 5e)。在1.5 M LiFSI DME中,NCM811颗粒被约18 nm厚的无定型电解液分解产物覆盖(图 5f)。相比之下,只有约2 nm CEI且没有相变的完整表面体现了1.5 M LiFSI DMMS 电解液和NCM811正极之间的良好相容性(图 5g)。除了电解液分解外,过渡金属溶出问题在碳酸酯和醚电解质中也很严重。使用1.5 M LiFSI DMMS电解液(表 S9)的电池的锂金属负极上检测到的Ni、Co和Mn的能量色散光谱(EDS)信号比对照组电解液弱得多,仅为碳酸酯电解液的1/38(表 S10)和DME电解液的1/25(表 S11)。溶出问题与对照组电解液中腐蚀性酸类物质的积累有关。此外,微裂纹增长(图 5h-j)进一步恶化了这种情况。表面重排,机械退化和伴生的正极阻抗升高等现象在对照组电解液中十分严重,但在很大程度上可以被硅氧烷电解液所抑制。
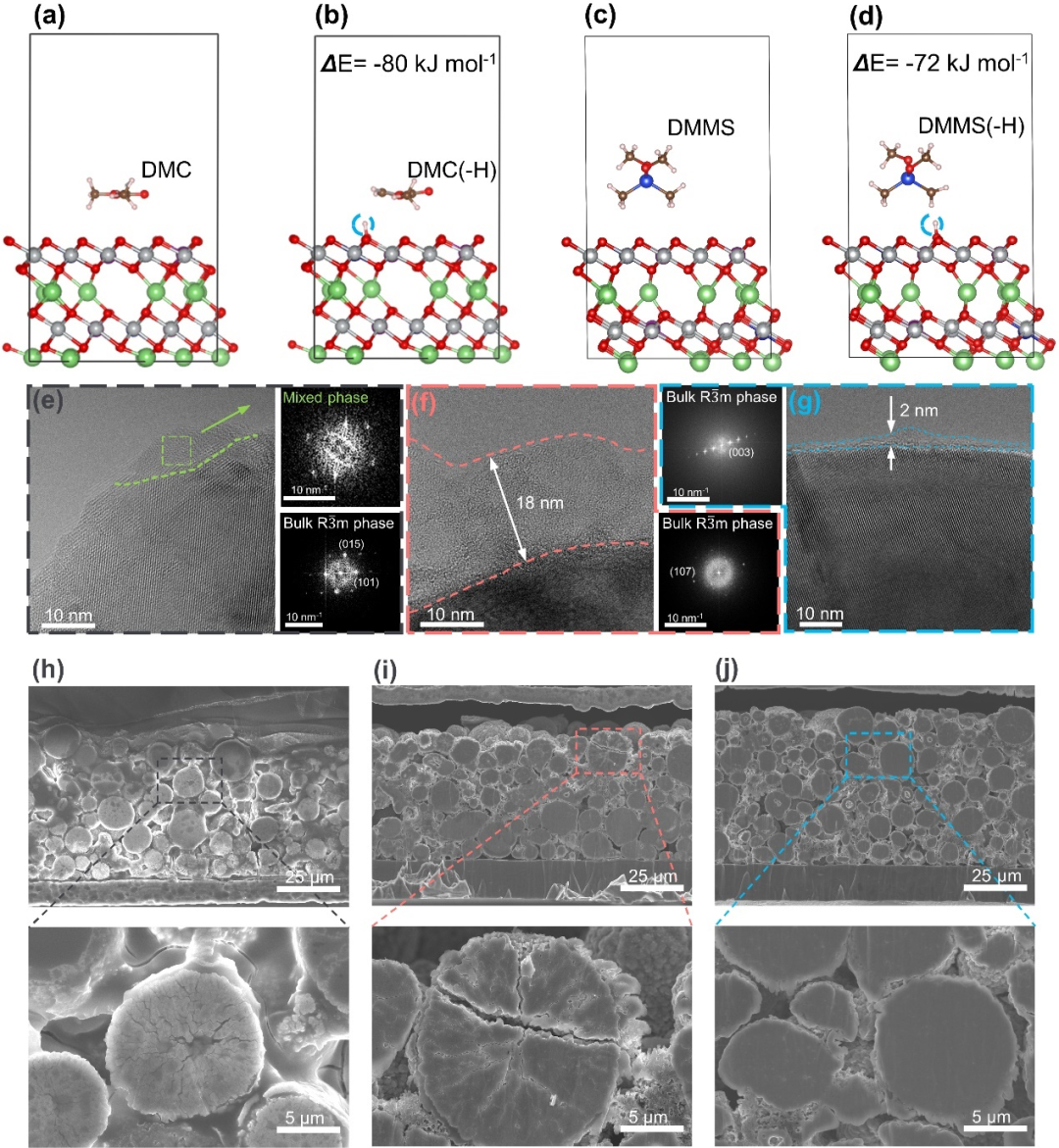
图 5. 正极-电解液界面的表征和计算模拟结果。(a-d),DMC(a, b)和DMMS(c, d)的氢转移计算。(e-g),100次循环后,使用1 M LiPF6 EC/DMC(1:1, v/v)(e)、1.5 M LiFSI DME(f)和1.5 M LiFSI DMMS(g)电解液的 NCM811正极的HR-TEM图像。(h-j),NCM811 电极在1 M LiPF6 EC/DMC电解液(h)、1.5 M LiFSI DME电解液(i)和1.5 M LiFSI DMMS电解液(j)中循环100次后的SEM横截面图像。
4. 电解液结构和设计原则
虽然溶剂的电化学稳定性可以通过分子设计来提高,但强化效果将受到电池中实际环境的影响。由于锂离子和阴离子的极化效应,电解液的电位窗口在还原和氧化极限侧都变窄了。一方面,当与Li+配位时,溶剂的还原电位上升,另一方面邻近的阴离子促进了溶剂的氧化反应。因此有必要研究电解液中以锂为中心和以溶剂为中心的代表性簇结构并考察它们的氧化还原行为。Li+-溶剂(图 6a)和Li+-阴离子(图 6b)的RDF表明,即使在低盐浓度下,阴离子也比硅氧烷更容易进入Li+溶剂壳。在1.5 M LiFSI DMMS中,典型Li+溶剂化结构(图 S33)按占比从高到低依次为3-1(即三个FSI-和一个DMMS)(33.59%)、2-2(24.22%)和4-1(19.14%)(图 6c)。这些富含阴离子的Li+溶剂化壳促进形成有利的富F、O的SEI,有效抑制了副反应。如图 6d所示,锂负极的CE随着Li+第一溶剂化壳中阴离子配位数的增加而增加。盐浓度的改变对LiFSI DMMS电解液中主要溶剂化结构的比例没有显著影响(图 6e和图 S35)。拉曼光谱进一步证实了这一计算结果(图 6f)。随着盐浓度的增加,Si-O(~625 cm-1)和FSI-(~750 cm-1)峰位的变化很小(蓝移小于10 cm-1)。在HCE/LHCE中,由于溶剂分子数不足,阴离子被动地进入Li+第一溶剂化壳,与之不同的是在我们的电解液中由Si-O键调节形成了有利的Li+溶剂化结构。Si-O键策略对电解质结构的全局优化能力(不限于单一的Li+溶剂化壳),在应对电解液氧化挑战方面发挥了重要作用。为了理解电解液在实际情况下的氧化行为,模拟盒子里的所有溶剂分子都被重新划分进五种以溶剂为中心的簇(图 S37)。如图 6g所示,分别为ⅰ)在自由溶剂域中的溶剂二聚体(Sol-Sol);ⅱ)仅与Li+相邻的溶剂(Sol-Li),即游离溶剂化Li+壳中的溶剂;ⅲ)近邻依次为Li+和阴离子的溶剂(Sol-Li-A),即接触离子对(CIP)和聚集体(AGG)的Li+壳层内的溶剂;ⅳ)近邻依次为阴离子、Li+的溶剂,即靠近CIP/AGG边缘的溶剂;ⅴ)紧邻自由阴离子的溶剂(Sol-A)。Sol-Sol簇的氧化电位近似代表纯溶剂的水平。受Li+极化效应影响,Sol-Li的氧化电位高于Sol-Sol。相比之下,Sol-A的抗氧化性最差,因为阴离子稳定了溶剂的正离子化产物并引发后续反应(H或F攫取反应等)以补偿从溶剂中离解电子的能量成本。当Li+和阴离子共同影响溶剂(Sol-Li-A或 Sol-A-Li)时,氧化电位取决于簇构象或两种极化效应的强度。总体而言,溶剂簇的氧化电位从高到低依次为Sol-Li > Sol-Sol > Sol-Li-A > Sol-A-Li > Sol-A(图 6h-j和图 S38)。整个电解质的耐氧化性应取决于最不稳定的簇。通过统计分析发现,与具有全部五种溶剂簇的基于DME(图 6i)和基于碳酸酯的电解液(图 S39)不同,1.5 M LiFSI DMMS电解液中仅存在Sol-Sol(35%)、Sol-Li-A(38%)、Sol-A-Li(27%)三种簇(图 6h)。因此,硅氧烷基电解质中的Sol-A-Li簇(5.67 V)决定了电解液的氧化电位,优于具有Sol-A簇的醚基(4.12 V)和碳酸酯基电解液(5.56 V for EC和5.65 V for DMC)。作者还考察了具有类似溶剂簇比例的1.5 M LiFSI 1,4-二恶烷 (1,4-DX)(图 6j),以证明设计的Si-O键和一般C-O键之间的差异。由于d-p共轭效应,无论哪种溶剂簇,DMMS的氧化电位都显著高于1,4-DX。1.5 M LiFSI 1,4-DX的Li||NCM811电池更差的循环性能进一步证实这一点(图 S40)。
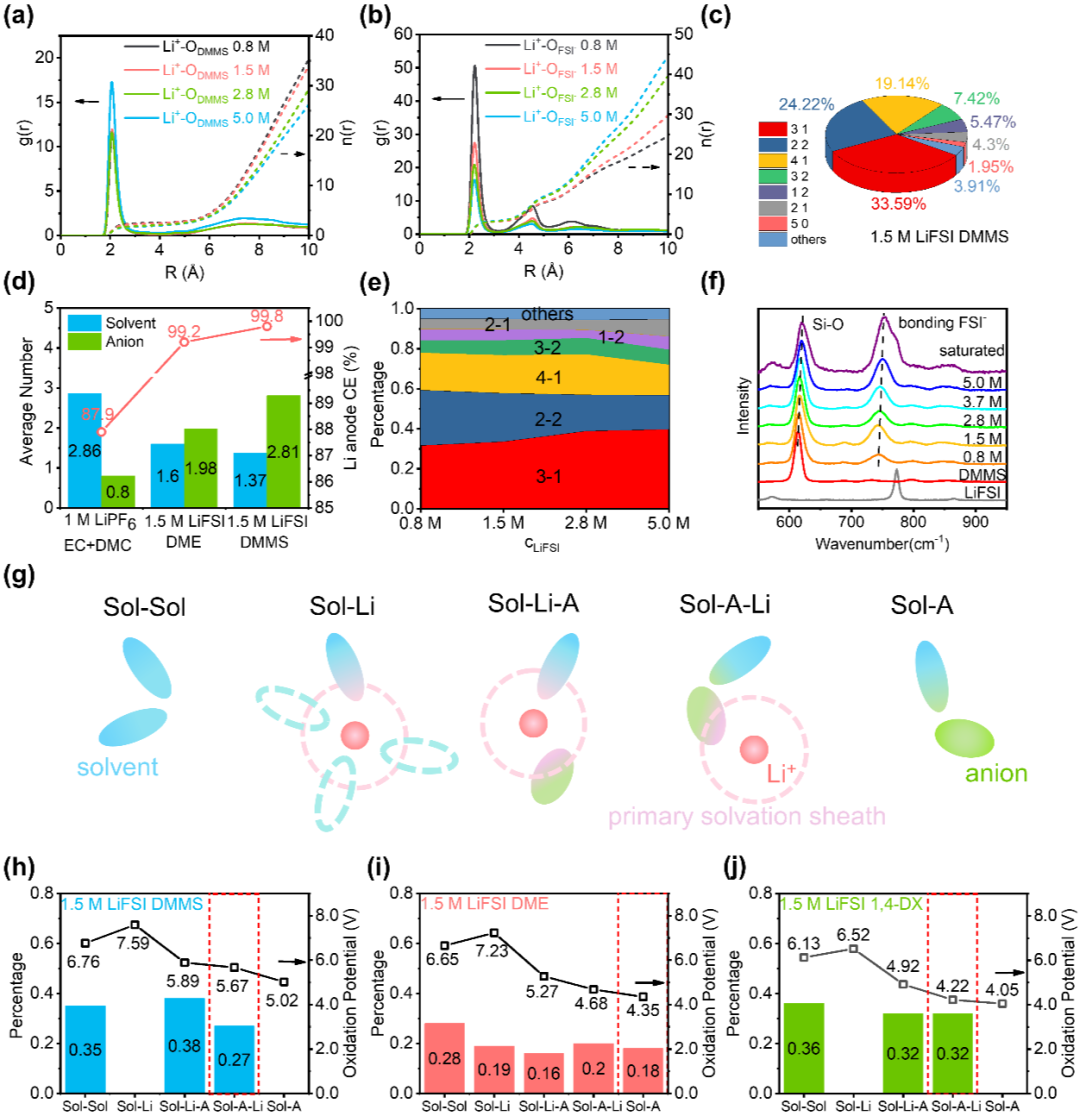
图 6. 硅氧烷电解液中的锂离子溶剂化结构。(a),(b),溶剂的氧原子(a)和阴离子的氧原子(b)在Li+周围的RDF。(c),1.5 M LiFSI DMMS电解液中Li+的第一溶剂壳中阴离子-溶剂比例的统计结果。(d),1.5 M LiFSI DMMS溶液与传统碳酸酯电解液和醚电解液相比,独特的溶剂结构和锂负极CE。(e),当增加LiFSI浓度时,Li+第一溶剂壳层结构在电解液中的演变。(f),LiFSI、DMMS及其不同浓度溶液的拉曼光谱。(g),溶剂的五种环境类型示意图:ⅰ)自由溶剂域中的溶剂二聚体,ⅱ)分离溶剂化Li+第一溶剂壳中的溶剂,ⅲ) 部分被阴离子占据的Li+溶剂壳中的溶剂,ⅳ)接近Li+溶剂壳中阴离子的溶剂,ⅴ)与自由阴离子接触的溶剂。(h-j),五种溶剂簇在1.5 M LiFSI DMMS(h)、1.5 M LiFSI DME(i)和 1.5 M LiFSI 1,4-DX(j)中的比例和氧化电位。电解液中存在的氧化电位最小的簇由红色虚线框起。
三、结论
利用高氟含量的电解液制造实用LMB的努力已被证明是有效的,但电解液中氟化物种的环境和经济成本却被忽视了。通过合理设计溶剂的官能团,我们证明了提高有限氟源(低盐浓度和非氟化溶剂)的氟输送效率可实现更好的电池性能。1)Si-O键策略有效地同时解决了C-O键的氧化问题和C=O键的还原问题。2)在分子间作用尺度上,硅氧烷消除了最容易氧化的Sol-A簇,但产生了大量富含阴离子的Li+中心簇。3)通过阴离子分解和溶剂强化形成稳定的富F、O SEI,进一步提高了电解液与LMA和高压正极的相容性。通过对这三个方面进行全局优化,即使在苛刻的条件下,硅氧烷电解液也能实现较好性能的LMB。比如Li||NCM811(3.5 mAh cm-2,N/P=1.1)和Li||LCO(4.5 V,3 mAh cm-2,N/P=1.3)等全电池取得了不错的长循环性能.电解液也通过了1.4 Ah Li||NCM811 软包电池(< 2.5 g Ah-1 贫电解质、20 μm 薄Li和> 3.6 mAh cm-2高载量正极)的验证测试。此外,我们展示了其在商业AG||NCM811软包电池中的普适性。这项工作中的化学键设计理念为可持续和实用的LMB的电解液研究提供了一个新的可能的方向。
四、文献详情
Yiqiang Huang, Ruhong Li, Suting Weng, Haikuo Zhang, Chunnan Zhu, Di Lu, Chuangchao Sun, Xiaoteng Huang, Tao Deng, Liwu Fan, Lixin Chen, Xuefeng Wang, and Xiulin Fan, Eco-friendly electrolytes via robust bond design for high-energy Li-metal batteries,Energy Environ. Sci., 2022.
DOI: 10.1039/D2EE01756C
https://doi.org/10.1039/D2EE01756C
五、作者简介
范修林,浙江大学百人计划研究员,博士生导师。分别于2007年和2012年在浙江大学取得本科和博士学位(导师为陈立新教授),2013-2017年在马里兰大学从事博士后研究(合作导师为王春生教授),2017年提升为助理研究科学家。2019年8月加入浙江大学材料学院。从事锂/钠电池电解液、固态电解质及相关界面方面研究,在Nature Energy, Nature Nanotech., Nature Commun., Science Adv., Joule, Chem, Energy Environ. Sci., J. Am. Chem. Soc., Adv. Mater.,等期刊发表论文150余篇。连续入选“科睿唯安(Clarivate)”全球高被引学者。论文被引用19000余次,H-index为72。
王雪锋,中国科学院物理研究所特聘研究员,博士生导师。主要从事高能量密度二次电池(锂离子电池、金属锂电池、混合锂离子/锂-氧电池和全固态电池等)关键材料结构表征、机理研究和失效分析,擅长采用冷冻电镜技术研究辐照敏感材料。至今已在Nature Mater.,J. Am. Chem.Soc.,Chem. Rev., Joule, Energy Environ. Sci.等国际知名学术期刊上发表学术论文60余篇,引用5300余次, H-index为37。
来源:能源学人
锂电联盟会长向各大团队诚心约稿,课题组最新成果、方向总结、推广等皆可投稿,请联系:邮箱libatteryalliance@163.com或微信Ydnxke。
相关阅读:
锂离子电池制备材料/压力测试!
锂电池自放电测量方法:静态与动态测量法!
软包电池关键工艺问题!
一文搞懂锂离子电池K值!
工艺,研发,机理和专利!软包电池方向重磅汇总资料分享!
揭秘宁德时代CATL超级工厂!
搞懂锂电池阻抗谱(EIS)不容易,这篇综述值得一看!
锂离子电池生产中各种问题汇编!
锂电池循环寿命研究汇总(附60份精品资料免费下载)
