随着医疗技术的进步,智能医疗领域的突破使实时患者数据的收集和主动诊断成为可能医疗技术的进步。因为葡萄糖是细胞重要的能量来源,所以监测葡萄糖指标的稳定对于最大程度减少糖尿病相关问题至关重要。然而,尽管市售的葡萄糖监测设备种类繁多,但重复血液测试带来的痛苦和复杂的电力需求仍是监测设备存在的缺点。
为了解决这些缺点,Min-Hsin Yeh与团队提出了基于自修复水凝胶的摩擦电生物传感器(GAH-TES)。在葡萄糖存在的情况下,动态水凝胶网络的调制导致电导率变化从而提高电性能。再引入摩擦生电纳米发电机(TENG),实现通过人体排汗的汗液实时监测高血糖水平,从而实时监测糖尿病。相关研究成果以“Enabling glucose adaptive self-healing hydrogel based triboelectric biosensor for tracking a human perspiration”为题发表在Nano Energy期刊上。

包裹在β-环糊精(β-CD)中的葡萄糖氧化酶(GOx)由于其可拉伸性、无毒性和高选择性而被掺入PVA基质中。GAH在有葡萄糖时有响应,GOx酶促反应氧化葡萄糖后产生葡萄糖酸与H₂O₂。当葡萄糖浓度升高时离子强度的增加使得机械化学键断裂从而导致渗透溶胀,增加了水凝胶基质的电导率,而电导率的变化促进了TENG系统摩擦起电。GAH是一种柔性电导体,并且在接触带电过程中表现出强烈的极化效应。当GAH吸收的葡萄糖浓度从0增加到500 μM时,TENG有更高的输出性能。GAH-TES成功实现了自我驱动和连续的血糖监测。
PVA作为GAH的基础网络。β-CD作为该水凝胶的受体连接PVA构成的基础网络上。为了确保GOx存在于稳定的环境下,将其通过非共价包裹在β-CD的空腔中。柠檬酸(CA)交联的存在提供了氢键和额外的结合位点,使β-CD和GOx之间形成的包合物稳定,如图1(a)所示。该研究通过对PVA/CA/β-CD水凝胶进行了衰减全反射傅里叶变换红外光谱(ATR-FTIR)分析,将CA交联PVA水凝胶与纯PVA水凝胶进行比较,显示在1712 cm⁻¹附近出现了新的振动带,这表明C=O的形成,证实了CA在PVA基水凝胶中的化学交联,如图1(b)所示。

由于GAH基于GOx 酶促反应进行葡萄糖浓度的监测,酶促反应会导致水凝胶溶胀从而影响吸水能力和机械强度。该研究为了确定水凝胶中最佳PVA浓度,研究了PVA水凝胶的溶胀时间。将含有5%、10%和15% wt PVA水凝胶浸泡在含有200 μM H₂O₂的PBS溶液观察溶胀速率,得出PVA水凝胶的最佳吸收时间为60 min,如图2a。而就高强度和吸收能力而言,10 wt% PVA是制备GAH的最适配比。研究人员研究了最适配比10 wt% PVA下GAH对H₂O₂吸附效率与电导率的关系及水凝胶的溶胀效率,如图2b。当H₂O₂浓度从0增加到500 μM时,基于PVA水凝胶的TENG的输出电压增加,如图2c和2d所示。

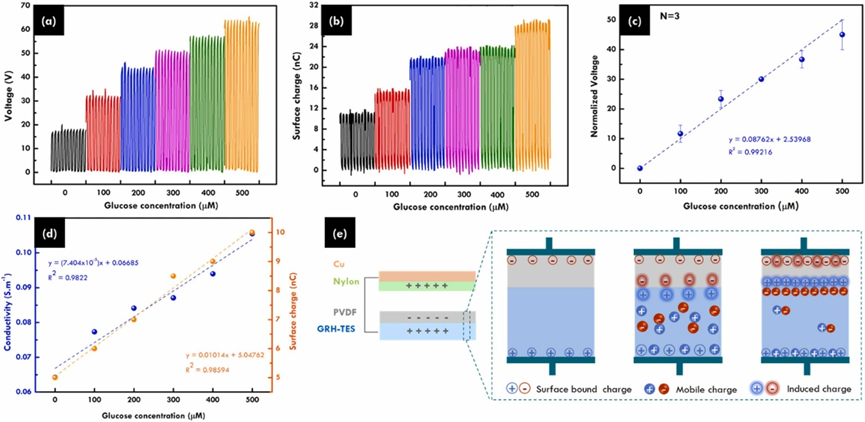
接下来,文章给出了GAH-TES传感器中TENG的测试。对于汗液0 ~ 500 μM葡萄糖浓度的实时检测,结果显示当葡萄糖浓度从0增加到500 μM时,TENG的输出电压信号变化为15 V ~ 65 V。并再次进行重复检测,如图3c。文章根据微观欧姆电磁定律,提出了酶促反应过程中产生的电荷增加与水凝胶电导率增加的比例关系,测试了在不同葡萄糖浓度下,PVDF表面电荷增加以及水凝胶电导率增加的类似趋势,如图3d。该现象可由GAH的界面极化来解释,即H₂O₂氧化产生的H⁺和PVDF与GAH界面积聚的空间电荷形成的界面极化引起的离子极化效应可以提升摩擦电性能,图3e给出了相应的示意图。
之后,该研究展示了GAH-TES用于人工汗液葡萄糖监测传感性能的相关测试。首先验证了GAH-TES信号主要由葡萄糖影响,尤其在葡萄糖为400 μM时,表现出了高选择性,如图4a。并对该传感器具备长期稳定性、再现性和可重复性进行了测试,如图4b-4d。

此外,研究人员又对GAH-TES的自修复和弯曲稳定性做了测试。通过搭建电路来直观地展示GAH的自修复特性,如图5a-5b所示。通过对GAH进行超过3000次循环长期弯曲,得到GAH-TES在存在机械运动的情况下仍能提供稳定和可靠的电信号,如图5c所示。

最后,该研究给出了自供电GAH-TES在人体汗液血糖监测中的实际应用。即当葡萄糖浓度过高时,GAH-TES的电压信号就会有所响应并点亮LED,如图6a。并对实际汗液样本下葡萄糖浓度变化时GAH-TES带来的响应进行了测试,如图6b所示。

综上所述,该基于自修复水凝胶的摩擦电感应传感器(GAH-TES)可用于人体汗液中的无创葡萄糖监测,并且该设备具备长期稳定性、可再现、可重复使用的特性。





