
相控阵全息声镊系统及在体操控细胞聚集示意图
6月6日,中国科学院深圳先进技术研究院郑海荣研究员团队开发出一种相控阵全息声镊操控技术,在生物体及血流中成功实现了对含气囊细菌群的无创精准操控和高效富集,在动物模型中实现了肿瘤靶向治疗应用。相关成果发表于《自然》旗下期刊《自然—通讯》上。该研究中,深圳先进院为论文唯一通讯单位。

文章上线截图
据了解,该相控阵全息声镊系统基于高密度面阵列换能器产生可调谐三维体声波,通过对空间声场在活体血管内等复杂环境中的时空精准调控,成功操控了含气囊细菌团簇,使其精准地移动到目标区域并发挥治疗功能,有望为肿瘤的靶向给药和细胞治疗等提供一种理想手段。
光声电磁等物理手段被认为是实现“隔空取物”非接触操控物体的可能途径。例如,光镊(2018年诺贝尔物理学奖)操控技术便在微纳尺度颗粒操控上展示出精准优势,但其在不透明的生物体中穿透深度十分有限。另外,磁镊操控技术一般需要磁性颗粒的结合黏附,这使得细胞活性受限,影响治疗效果。
“相较而言,基于高频声波梯度声场设计的声镊在生物体系中具有作用力大、穿透性强、操控通量高和无需标记等独特优势。”论文通讯作者郑海荣表示,如果能运用声学的方法,不需要介入手段,就能像“隔空取物”般,将药物和治疗细胞精准运送到生物体病灶部位,将解决临床治疗的一大难题。
基于上述难题,郑海荣研究员带领深圳先进院医学成像团队经过十多年声操控技术积累,基于超声辐射力作用原理,利用高密度二维平面阵列和多通道可编程电子系统,结合三维声场调制、超声成像和时间反演算法,提出并构建了可编程相控阵全息声镊理论、技术和仪器体系,为生物体等复杂环境下的精准声操控奠定了基础(如图1)。
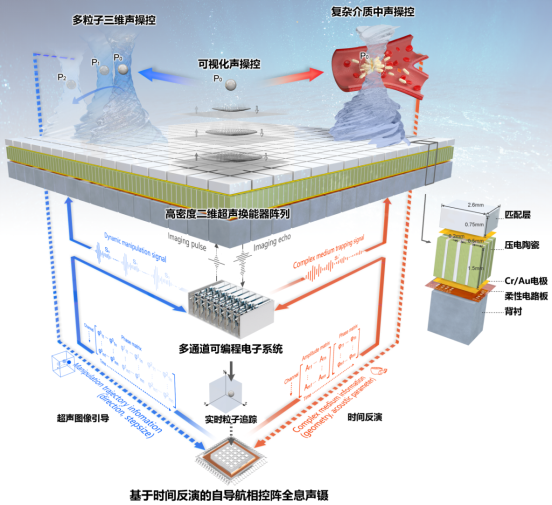
图1:相控阵全息声镊系统示意图
(Research,2021)
团队分析了不同声学性质粒子的辐射力响应特性,开创性地利用时间反演矫正声波穿越非均匀介质中产生的畸变,并将超声成像与三维声操控相结合,实现了非透明非均匀介质中的自导航三维声镊,率先突破了复杂环境中声操控面临的瓶颈问题。团队继续在相控阵全息声镊领域深耕,推动了二维高密度超声阵列的微型化,融合显微成像,初步实现了细胞、微生物等的离体三维声操控验证,进一步结合基因编辑等技术,着力推动可编程相控阵全息声镊在各领域的关键应用。
这一次,团队推动相控阵全息声镊高精度高通量操控技术取得了生物医学应用的突破,率先实现了在体声操控细菌对于实体肿瘤的靶向治疗(如图2)。
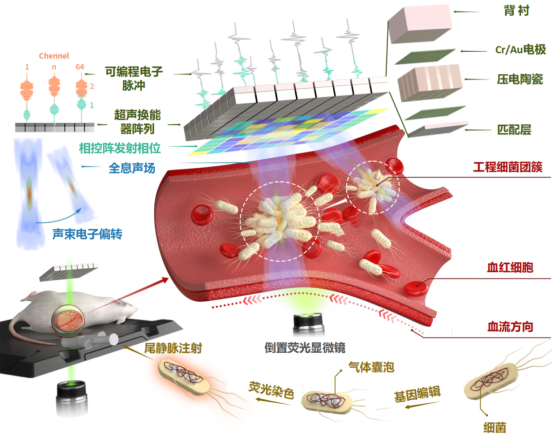
图2:相控阵全息声镊系统在体操控细胞示意图
(NatureCommunications,2023)
论文同行评议专家表示,该研究在活体内实现了声操控基因工程菌,研究是在正常血流的血管中进行的,这是非常重要的一步,因为血流是一个极具挑战性的环境因素。他们在血管中成功声操控载泡细菌的事实,为其生物医学应用打开了大门,例如声学操控靶向给药。因此,该研究描述并介绍了声镊与靶向治疗技术的结合,将在未来几年被广泛研究和应用。
生物体内环境极其复杂,受组织器官、骨骼、血管、血流等环境因素影响,在这样复杂的环境中,应该如何运用声学手段“抓住”能够产生治疗肿瘤效果的细菌,并使之发挥功效,实现“隔空取物”?
研究团队成员马腾研究员表示,生物体内复杂的环境因素,对声场的建立和超声的抗干扰性有着极大的挑战。从理论研究层面,研究团队提出了复杂声场环境中声辐射力离散表达与计算理论,解决了复杂声场的任意结构微粒受力量化表征的瓶颈问题,并探究了复杂环境中空间声场作用下操控目标的动力学行为。从工程研发层面,团队通过长期的技术探索与积累,攻克了高密度声镊换能器研发中声场设计和制造工艺等难题,成功研制了二维高密度超声换能器阵列,利用全息元素构建和时间复用的方法,结合多通道高精度时间反演超声激励,实现了强梯度声场生成和复杂声场的时空动态调控。
“通过二维高密度超声换能器阵列形成的强梯度声场,就像无形的‘镊子’,在病灶处建立起全息立体声场,控制细菌精准地按照预设路线,到达病灶部位。”马腾说道。
离体条件下声操控基因编辑细菌
从生物医学应用层面,研究团队中严飞研究员等利用基因编辑技术,在细菌细胞中产生了亚微米气体囊泡,该气囊的存在显著提高了基因工程细菌的声学敏感性,使其可以在声场中被辐射力主导下聚集成团簇。特别地,通过构建动物模型,结合显微成像与相控阵全息声镊,克服复杂生物体组织结构和高速血流的影响,成功使这些细菌团簇能够逆流或按需流动到活小鼠的预设血管中,展示出了优异的时空操控精度。另外,高通量相控阵全息声镊操控技术可以显著提高肿瘤中工程细菌的聚集效率,结合细菌的肿瘤细胞毒性,可明显延缓肿瘤的生长,大幅延长荷瘤小鼠的存活时间。
小鼠活体血管中声操控基因编辑细菌
郑海荣表示,该研究证明了相控阵全息声镊仪器系统可以作为一种活体内非接触精准操控细胞的新工具。以相控阵全息声镊为手段,功能细胞及细胞球为载体,在免疫治疗,组织工程,靶向给药等方面都有令人兴奋的应用潜力,如声操控CAR-T、CAR-M细胞突破固体肿瘤屏障;干细胞、类器官在体定制化声组装;病灶处载药细胞的声聚集等,在超声治疗、超声给药及神经调控等方面具有重要转化价值。




