
皮肤在人体中扮演着重要的角色,作为人体与外界的主要接口和保护层。它的感知能力和柔软性使我们能够感知外部刺激并在复杂环境中执行任务(图1A)。然而,患有皮肤损伤或截肢的人可能会遇到感知和行动之间的困难。尽管假肢可以部分恢复运动功能,但仍存在局限性,如幻肢疼痛和手指灵活性不足,需要整合感觉反馈和柔韧性来解决。为了实现自然的人机界面,研究人员努力赋予电子系统以人体皮肤的特性。
目前,已经开发了复杂的硅电路来模拟外周神经系统,在假肢和机器人中实现类似皮肤的感知能力。然而,在一个单一的设备平台上构建集成的、柔性的电子皮肤仍然是一个挑战。尽管柔性电子学和电路制造取得了进展,但其应用仍受限于用于互连线路的主动矩阵阵列和传感器信号放大。神经假肢的电子皮肤需要提供类似神经的脉冲列信号模式,以实现自然感觉和调节运动活动。虽然压电、摩擦电和离子压力传感器可以生成类似尖峰列的信号模式,但生物感觉受体使用调频信号编码输入幅度信息,需要信号数字化和调节电路以实现人工突触,从而触发身体运动(图1B)。
最近,来自斯坦福大学的Weichen Wang等人报道了一种单片集成、低电压驱动的软性电子皮肤系统,该系统没有任何刚性电子组件,可以模拟生物皮肤的感觉反馈功能,包括多模式接收、类似神经的脉冲列信号调节和闭环驱动(图1C,D)。该系统采用了三层高介电常数(κ)、可伸缩介质的设计,将可伸缩电路的驱动电压降低到几伏特,以实现安全高效的在体操作。这一创新有望为截肢患者提供更好的假肢感知和控制能力,推动人机界面技术的发展。
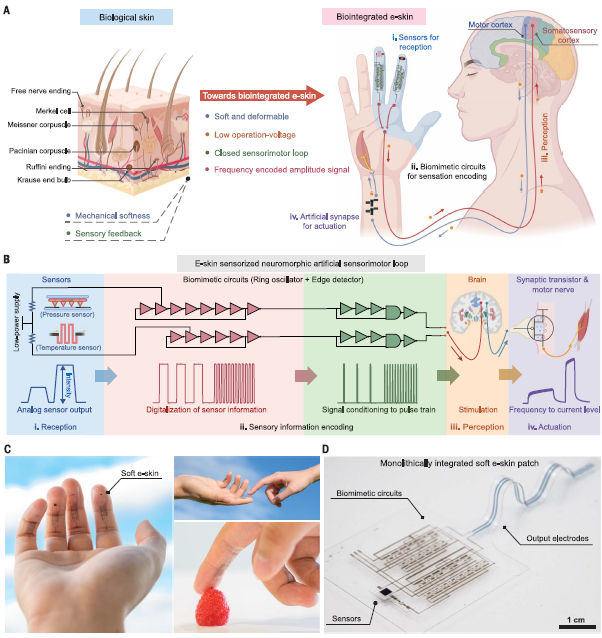
图1 低电压驱动的人造软体电子皮肤系统实现了生物仿生的双向信号传输。
# 低电压驱动、高性能、可拉伸的有机晶体管
现有的可伸缩有机电子仍需要高工作电压,有着安全和能耗方面的问题。而降低驱动电压需要增加栅电容,需要具有高介电常数的薄介电层(图2Ai)。丁腈-丁二烯橡胶(NBR)是一个很有前途的候选材料,其介电常数高,可以在广泛的频率范围内保持良好的稳定性(图2B),这一特性对于晶体管和电路的稳定运行至关重要。研究人员开发了一种直接光图案化方法(最小可达2μm),采用紫外光诱导的叠氮交联反应。交联的NBR具有耐溶剂性,然而测试表明晶体管的转移曲线显示出大的滞后和低迁移率,这可能是由于高极性丁腈基团引起的半导体-介电界面处能级混乱。这种高κ值和高陷阱密度之间的权衡使得在可伸缩有机器件中实现低驱动电压和高载流子迁移率颇具挑战性。
为了克服这个挑战,研究人员接着开发了一种三层电介质,通过用超薄的非极性聚(苯乙烯-乙烯-丁二烯-苯乙烯)(SEBS)弹性体涂层对高κ 的NBR进行钝化,随后使用疏水性的十八烷基三甲氧基硅烷(OTS)进行分子修饰(图2A)。这种具有适当表面能的介电堆叠在可伸缩半导体层能够中诱导出理想的纳米限制形态,从而实现高载流子迁移率,与单层NBR电介质相比,在三层设计中,载流子迁移率提高了约50倍,同时保持了低驱动电压(图2C)。为了量化界面陷阱密度,研究人员测量了各种电介质设计的电荷传输的活化能(EA)。NBR-SEBS-OTS与直接旋涂半导体的组合显示出最低的EA(图 2D)。在SEBS和OTS层沉积后,击穿电压稳定增加,表明针孔减少,这种三层电介质同时实现了低工作电压和高载流子迁移率(图2E,F)。
研究人员利用具有良好耐溶剂性和可图案化性的高κ三层电介质,取得了重要进展,实现了可扩展且无需转移的低电压驱动可伸缩晶体管阵列的制造(图2Aii)。所得到的阵列显示出可伸缩晶体管的特性,具有低栅漏电流、高迁移率高产率、高可伸缩性等优点(图2Aiii)。与先前报道的低κ可伸缩电介质相比,高κ三层电介质通过通道宽度归一化的跨导(Gm/Wch)提高了10倍以上,且实现了与刚性多晶硅晶体管相当亚阈值摆幅(图2G)。晶体管性能关键指标(驱动电压、亚阈值摆幅、跨导、开关比和泄漏电流)的改进使得我们的软性晶体管可以以低功率运行,其动态(1.7 pJ)和静态(0.25 pW)功耗都比现有可伸缩晶体管低100倍左右(图2H)。
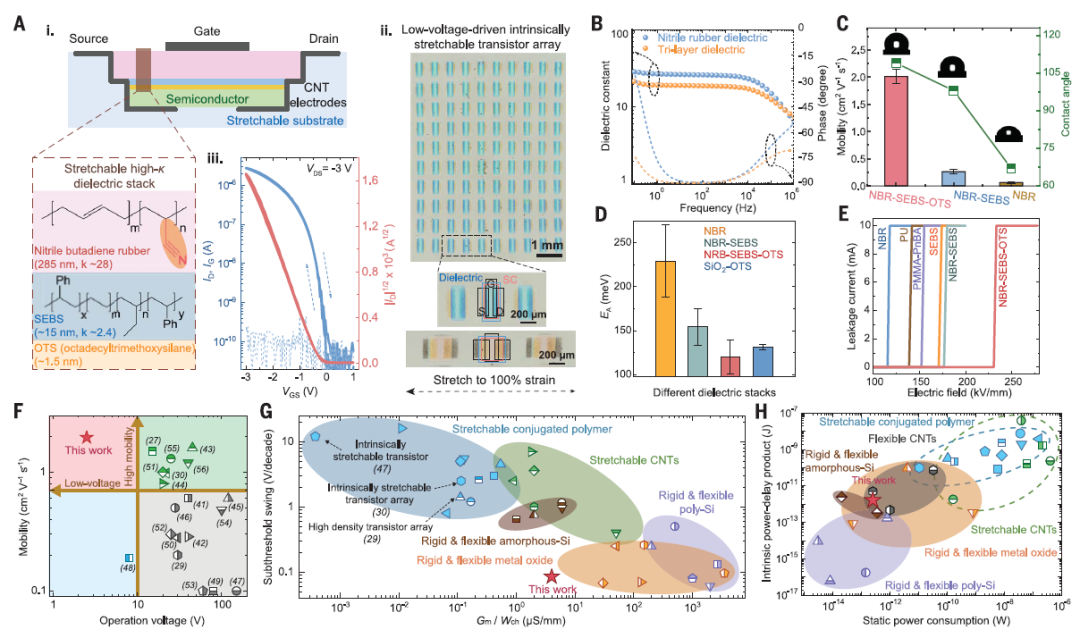
图2用于高性能和低电压可拉伸有机晶体管和电路的高κ三层电介质。
#用于产生仿神经脉冲的信号调节电路系统
研究人员通过优化单个晶体管的特性,成功集成了能直接在皮肤上运行的低电压功能电路,实现了模拟生物皮肤感受器的感觉功能。他们开发了一个电路系统,其中包括传感器、环形振荡器(ROs)和边缘检测器(EDs),以模拟自然感知过程中刺激信号的转换和传输(图3A-D)。为了解决频率调谐的问题,他们引入了一种新的设计,将传感器放置在感测反相器中,通过调整感测反相器的上拉充电电流,实现了幅度解耦的频率调制,具有宽动态范围和稳定的振荡幅度(图3E-F)。
随后,他们制造了多级RO用于区分来自多个传感器的信息,这对于实现可伸缩的多模态感知能力具有重要意义。为了更好地模仿脉冲列的生物编码过程,研究人员进一步开发了ED电路来“重塑”RO输出信号。通过适当设计的延迟网络和AND门,ED可以有效地捕获输入信号以生成稳定的脉冲信号(图3Gi)。然后,通过延迟网络、AND门和相应电路制造的最佳几何设计,他们实现了一种可伸缩的ED,可以生成具有不同频率的方波输入的稳定脉冲信号,其持续时间约为4ms,幅度约为5V(图3G)。
基于以上研究,他们随之开发了一个单片集成的柔性电子皮肤贴片,其驱动电压小于±5 V(图3B,C)。他们还将基于碳纳米管的可伸缩压力传感器和三维金字塔结构的薄膜温度传感器集成到系统中,分别模拟自然机械感受器和温度感受器(图3H)。当施加0-50 kPa的压力或将温度从22°C升至90°C时,脉冲列信号会生成并更快地响应压力和温度刺激水平(图3I,J)。整个电子皮肤电路由54个可伸缩晶体管组成,实现了可伸缩有机电子的中等规模集成(图3C,K)。
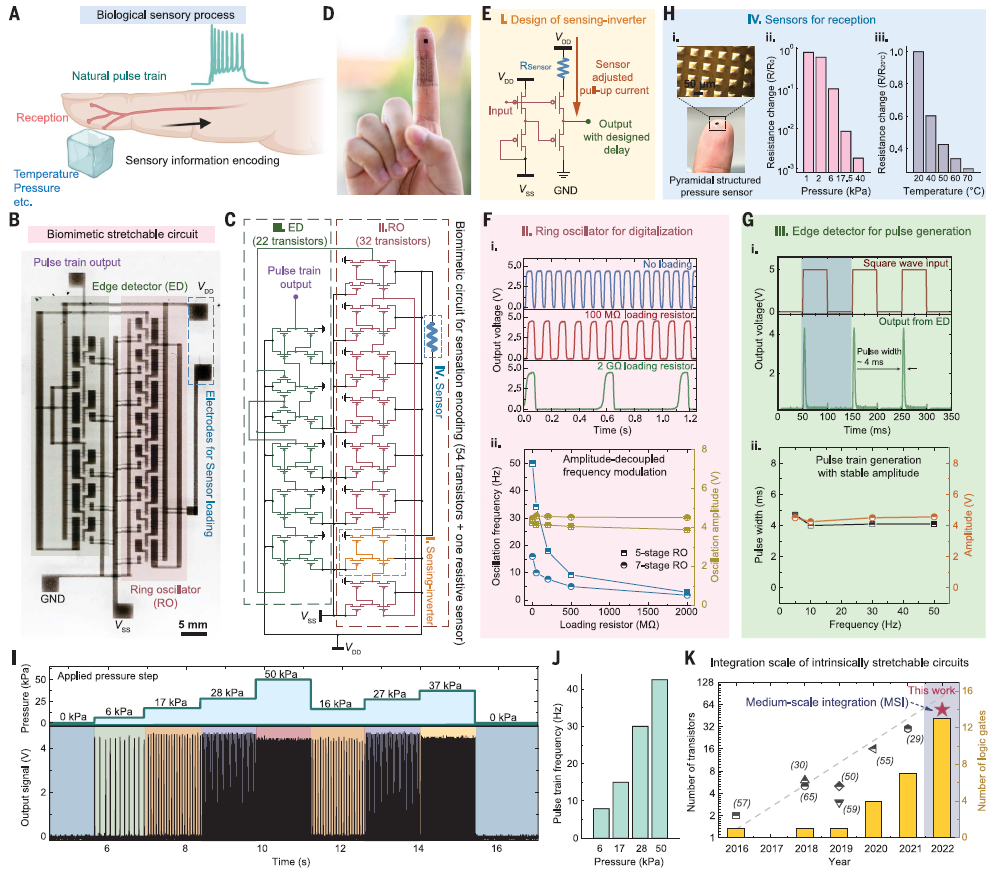
# 用于触发下游执行动作的全固态人工突触
自然感知反馈环路的一个特点是感知和行动之间的双向信号通信。研究人员成功开发了能够实现双向信号通信的固态离子突触晶体管,以完成感知和行动之间的传递(图4A,C)。为了解决将频率编码的传感器信息转换为不同身体动作水平的挑战,研究人员引入了基于离子门控的突触晶体管设计,具有类似生物突触的工作机制(图4B,D)。通过混合高离子导电性的离子导电弹性体(ICE)和单离子导电的聚电解质(PiTFSI),他们开发了固态离子介质(图4B),并通过叠氮交联剂对这种离子介质进行了图案化处理,制造出了全固态可伸缩的突触晶体管阵列,具有良好的均匀性(图4E)。实验结果显示,在不同频率的突触前脉冲输入下,突触后电流幅度发生了显著变化,即1 Hz和100 Hz输入之间的输出差异约为4个数量级,而扩展到800 Hz时输出差异约为7个数量级(图4D)。此外,经过长时间在生理液体中浸泡后(8小时),全固态人工突触的突触后电流变化较小,而含有小分子离子液体的突触则丧失了约98.2%的输出电流(图4F,G)。
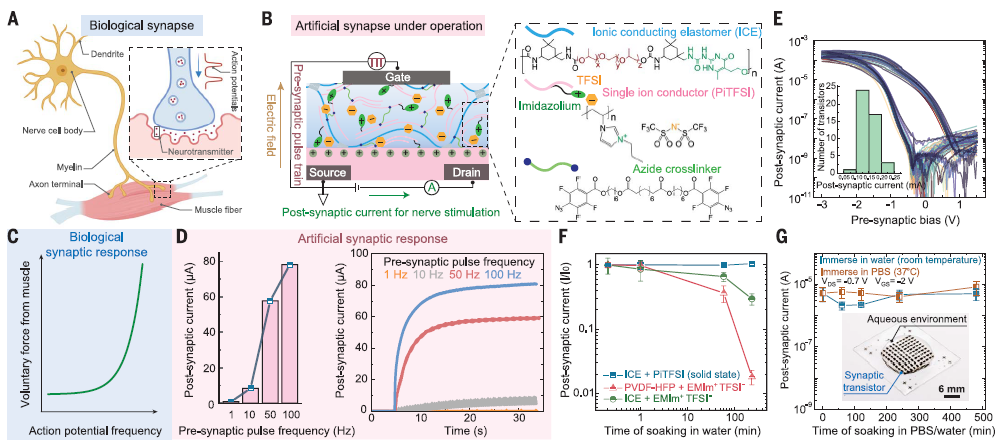
图4 基于输入门频率的全固态软人工突触,用于驱动下游身体运动。
# 通过单片柔性电子皮肤演示感知-运动回路
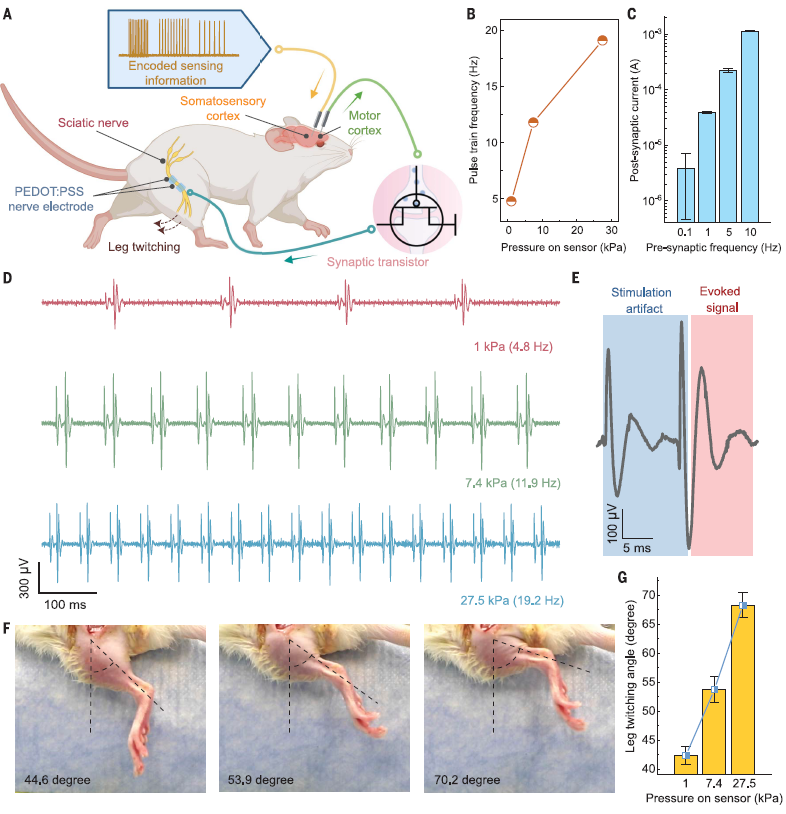
经过在小鼠模型中的测试,全固态人工突触的皮肤感知-肌肉激活回路在生物学上具有实用性(图5A-C)。首先,研究人员将柔性电子皮肤与小鼠的体感皮层连接起来以模拟皮肤感知,并期望触发运动皮层的反馈响应。随后,通过人工突触传递触发的运动信号,刺激坐骨神经实现下游肌肉激活,从而完成人工感知-运动回路。
实验结果表明,当传感器受到不同大小的力量作用时,体感皮层的数字化输入能够成功地在运动皮层引发反应(图5D,E)。经过进一步放大和信号处理后,利用记录的触发信号作为突触晶体管的门控输入,观察到突触后电流的幅度与施加的压力成比例。与自然感知反馈过程类似,更强的力量刺激引起双向电子皮肤系统产生更大的腿部抽搐角度,这与增加的压力输入相对应(图5F,G)。这些结果证明了人工电子皮肤在神经假肢中应用的潜在可行性。此外,该电子皮肤贴片在实验鼠皮肤上贴附了30小时,未观察到皮肤刺激性反应。
综上所述,我们的皮肤为我们的身体提供了一层保护层,但它也能提供详细的感官反馈和与周围环境的柔软互动。研究人员通过合理的材料设计和器件工程,实现了一个单体集成的柔性电子皮肤系统,无需刚性电子组件且具有低驱动电压、高电路复杂性和仿生感知反馈功能。这种神经形态系统将皮肤的所有所需电学和机械特性结合在一个单一的设备平台上,这一进展将有助于为发展下一代假肢皮肤、人机界面和神经机器人奠定道路。
免责声明:本文版权归原作者所有。本文所用视频、图片、文字如涉及作品版权问题,请第一时间告知,我们将根据您提供的证明材料确认版权并按国家标准支付稿酬或立即删除内容!本文内容为原作者观点,并不代表本公众号赞同其观点和对其真实性负责。


为您发布产品,请点击“阅读原文”
