多肽、蛋白质和抗体等生物制剂是过去十年中增长最快的药物类别。与小分子相比,它们具有较低的毒性、较高的结合亲和力和特异性,以及较好的药代动力学。然而,在药物开发过程中,许多此类化合物可能由于早期阶段就存在的溶解度差的问题,从而在晚期阶段导致代价高昂的药物开发失败,或者开发出来的产品在使用时缺乏便利性。例如,一些开发出来的生物制剂产品是以冻干形式进行储存,因此需要在给药前溶解,并通过静脉而不是皮下进行给药,这可能导致每次给药都需要去医院进行长时间的就诊,而无法实现居家给药。
据麦姆斯咨询报道,近期,英国剑桥大学(University of Cambridge)的研究人员提出了一种微流控平台,可以实现蛋白质相对溶解度的测量。该微流控平台仅需利用20 μg纯化蛋白质,即可获得超过10000个数据点,并最终实现对蛋白质溶解度的低成本、高通量测量。与以往的方法相比,该方法使得可获取的数据点增加了1000倍,同时所需材料减少了10倍以上。这种超高通量的方法可以在一个实验中优化多个变量。因此,该微流控平台具有简化药物开发过程的潜力,并可以大大增加研究人员对生物制剂的溶解度和辅料效果的认知。相关研究成果以“Multidimensional Protein Solubility Optimization with an Ultrahigh-Throughput Microfluidic Platform”为题,发表于Anal. Chem.期刊。
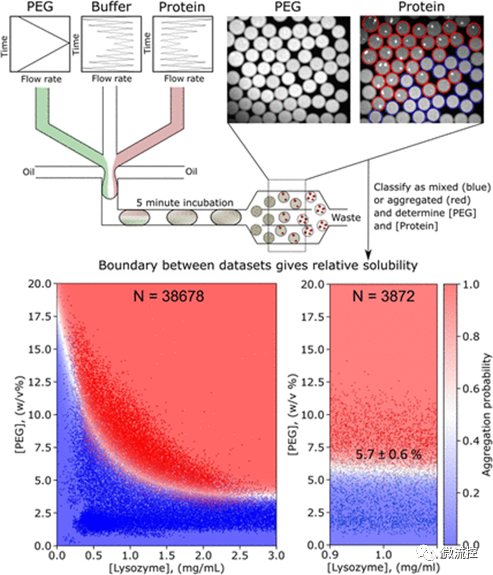
研究人员首先利用微流控技术生成了数千个含有蛋白质、辅料和沉淀剂的微液滴。通过调节含有蛋白质、缓冲液、聚乙二醇(PEG)和选定辅料的溶液的流速,可以创建一系列具有不同物质成分比例的微液滴。随后将荧光染料(游离于溶液中作为条形码或与蛋白质结合)添加到溶液中。将生成的微液滴“孵育”5分钟后,在与所添加的荧光染料相对应的波长下进行成像,即可以从荧光强度推断出液滴中化合物的浓度。此外,由于蛋白质带有荧光标记,研究人员可以通过直接观察来判断蛋白质是均匀地分布在液滴中,还是形成了沉淀物。如果蛋白质形成了沉淀物,液滴中会显示出明亮的光谱。
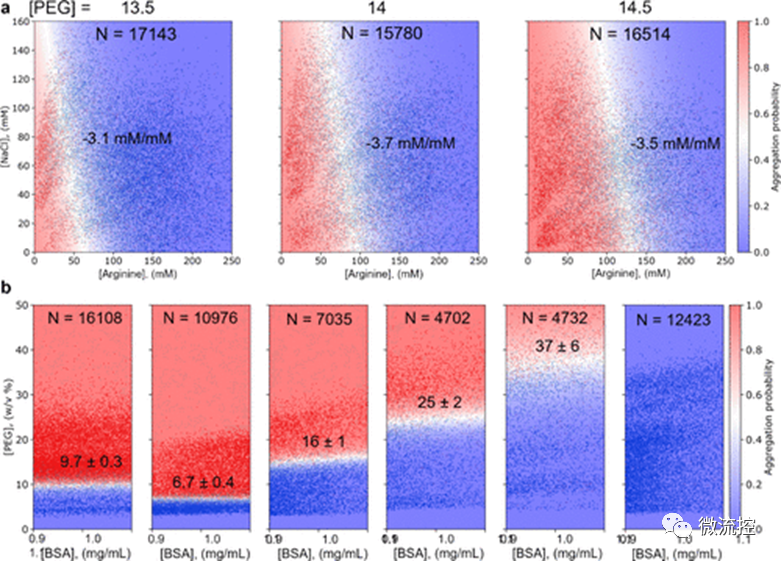
接着,研究人员对药物制剂配方中常用的辅料(例如氯化钠(NaCl)、组氨酸、精氨酸、蔗糖以及聚山梨酯20和80)在增加蛋白质溶解度方面的效果进行了量化研究。研究结果发现,正如在理想状态下所预期的那样,在给定的浓度范围内,辅料可以线性提高蛋白质的溶解度。通过比较图2中显示的白色边界的斜率,研究人员可以对这些辅料增加蛋白质溶解度的能力进行排名。此外,除了比较曲线的斜率,还可以利用曲线下面积(AUC)对这些辅料进行定量地对比。利用图2中的测量值,研究人员可以合理地设计一种配方来提高所研究的蛋白质的溶解度。

此外,使用该微流控平台,研究人员还可以在一项实验中以高分辨率研究不同辅料的组合效果,从而在优化配方时节省额外的时间和材料。另外,pH值是影响蛋白质溶解度的另一个重要因素,因此,研究人员使用微流控平台对该影响因素进行了探索。研究人员分别测量了牛血清白蛋白(BSA)在处于pH = 4、5、6、7、8和9的缓冲环境的制剂中的溶解度(图3b)。结果发现,在pH = 4时,BSA的相对溶解度为9.7% ± 0.3% PEG,在pH = 5时,BSA的相对溶解度为6.7% ± 0.4% PEG。因此,如果只考虑溶解度,pH = 4的配方更优。此外,增加pH值也可以显著提高溶解度,当pH = 9时,BSA的溶解度非常高,以至于在该实验条件下无法确定BSA的溶解度数值。此外,值得注意的是,与以往的测量方法相比,图3所示的基于微流控平台的测量方法需要的蛋白质量减少了90%,“孵育”时间也从2天显著减少为5分钟,并且由于测量过程中可以获得数千个数据点而不是仅仅几十个数据点,采用微流控平台的测量方法,其测量误差更小。
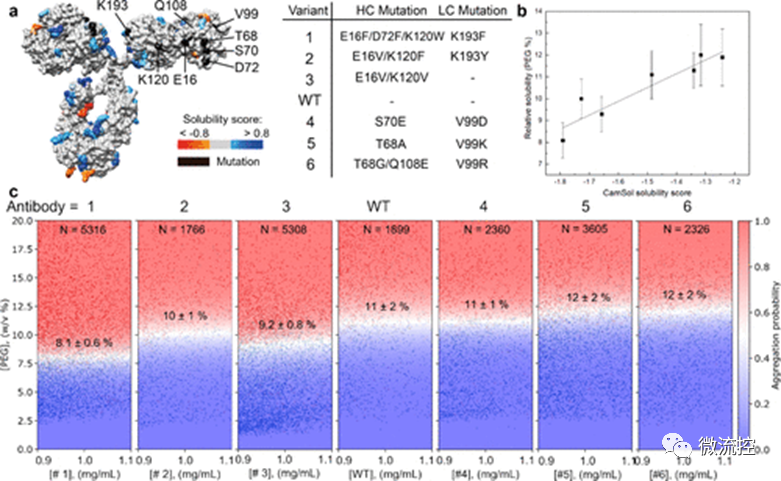
另一种提高蛋白质溶解度的方法是使蛋白质发生突变,以获得更多的可溶性突变体,同时保持其所需的其它功能。该研究所提出的微流控平台可以成功用于测量蛋白质突变体的溶解度。图4a显示了野生型IgG4抗体和研究人员所设计的六个突变体的结构。研究人员首先利用CamSol方法对这些突变体的相对溶解度进行了预测,预测结果显示,突变体1~3比野生型IgG4抗体的溶解度低,而突变体4~6比野生型IgG4抗体的溶解度高(图4b)。随后,研究人员利用该微流控平台对突变体和野生型IgG4抗体的溶解度进行了测量,测量结果显示,突变体1~3确实具有较低的相对溶解度,而突变体4~6具有较高的溶解度。值得注意的是,完整的IgG4抗体具有约1350个残基,而这些突变体仅存在2~4个突变点,即使在这样的情况下,该微流控平台也可以有效地选择出溶解度更高的突变体,从而有效优化蛋白质序列。
总体而言,优化蛋白质的溶解度仍然是开发基于蛋白质的药物的重大挑战。然而,现有技术对材料的要求很高,并且没有足够的通量来测量早期开发过程中的蛋白质溶解度或广泛优化配方。该研究提出了一个可以同时解决这两个问题的微流控平台。该微流控平台可以量化通过加入不同种类和不同浓度的配方辅料所获得的蛋白质溶解度的提升效果,并优化pH值以提高蛋白质药物的溶解度。此外,该方法可以对蛋白质突变体进行准确的溶解度排序,即使这些突变体仅存在几个突变点。因此,该微流控平台提供了一种高度定量的策略,可用于改善影响蛋白质溶解度的各个因素,并有助于开发新的基于蛋白质的药物。






