基因疗法和光电技术可以从根本上提升数百万人的听力。
自然听力是由振动撞击内耳耳蜗里名为“毛细胞”的微小结构所产生的。人工耳蜗能绕过耳朵中受损或功能失调的部分,使用电极直接刺激耳蜗神经,再由该神经向大脑发送信号。我的听障患者们经常在第一次打开自己的人工耳蜗时表示声音听起来没有起伏,像机器人一样,而且背景噪声掺杂在一起,淹没了声音。虽然用户可以与技术人员多次沟通,调整其人工耳蜗设置,让声音听起来更悦耳、更有帮助,但如今的技术所能实现的效果有限。
我已经做了20多年的耳鼻喉科医生。我的患者们表示,他们想听到更自然的声音,更好地享受音乐,最重要的是,他们希望更好地理解语言,特别是在有背景噪声的环境中,也就是所谓的“鸡尾酒会问题”。15年来,我在德国哥廷根大学的团队一直在与弗赖堡大学等高校的同事合作,希望利用光这种明显反直觉的方式开发新型人工耳蜗。
我们发现,如今的人工耳蜗遇到了工程学和人体生理学的硬性限制。因此,我们正在开发一种新的人工耳蜗,它能使用光发射器和对光有反应的基因改变细胞。通过使用精确的光束而不是电流来刺激耳蜗神经,我们期望光学人工耳蜗能够更好地复制声音的全频谱特性,更好地模拟自然听力。我们计划于2026年开始临床试验,如果一切顺利,下一个十年开始时,我们的设备将获得监管部门的批准。届时,全世界的人们都可以开始听到光。
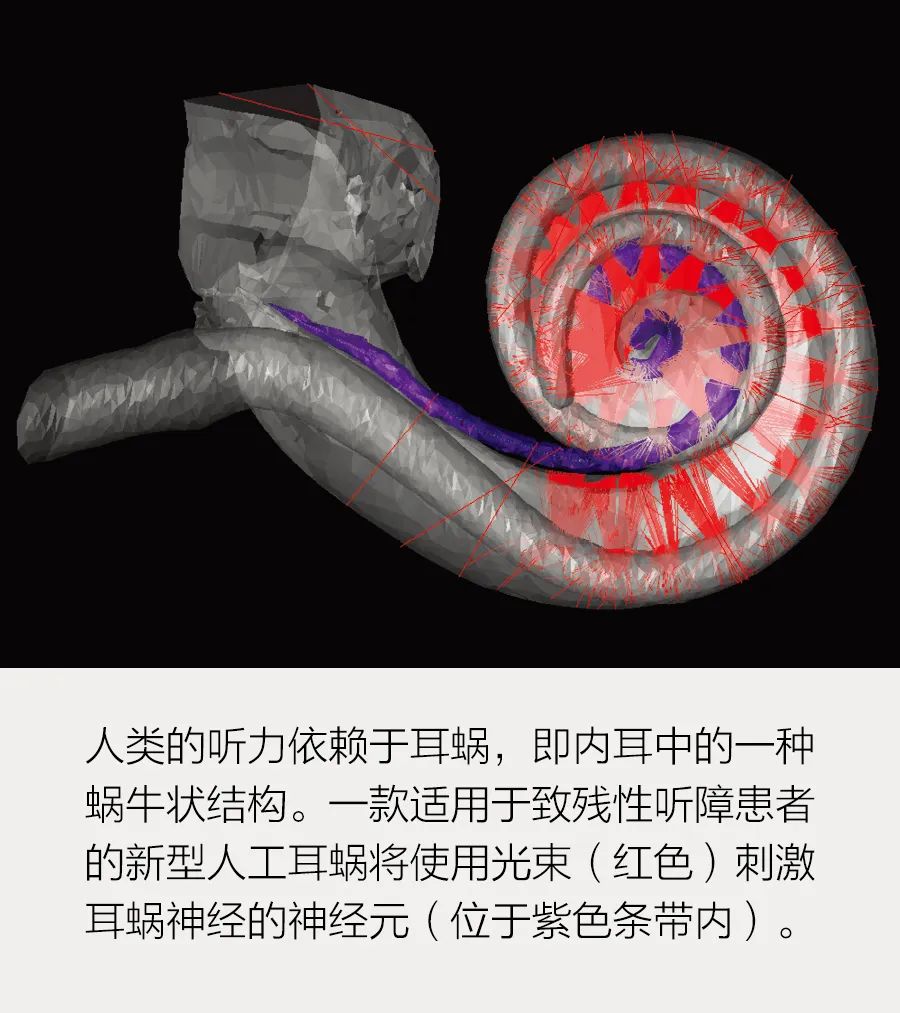
如今的人工耳蜗是迄今为止最成功的神经假体。第一款人工耳蜗于20世纪80年代获得美国食品和药品监督管理局的批准,到2019年,全球已植入近73.7万个人工耳蜗。但它们对耳蜗中可用于声音编码的神经元的利用有限。要理解为什么,我们首先需要了解自然听力的工作原理。
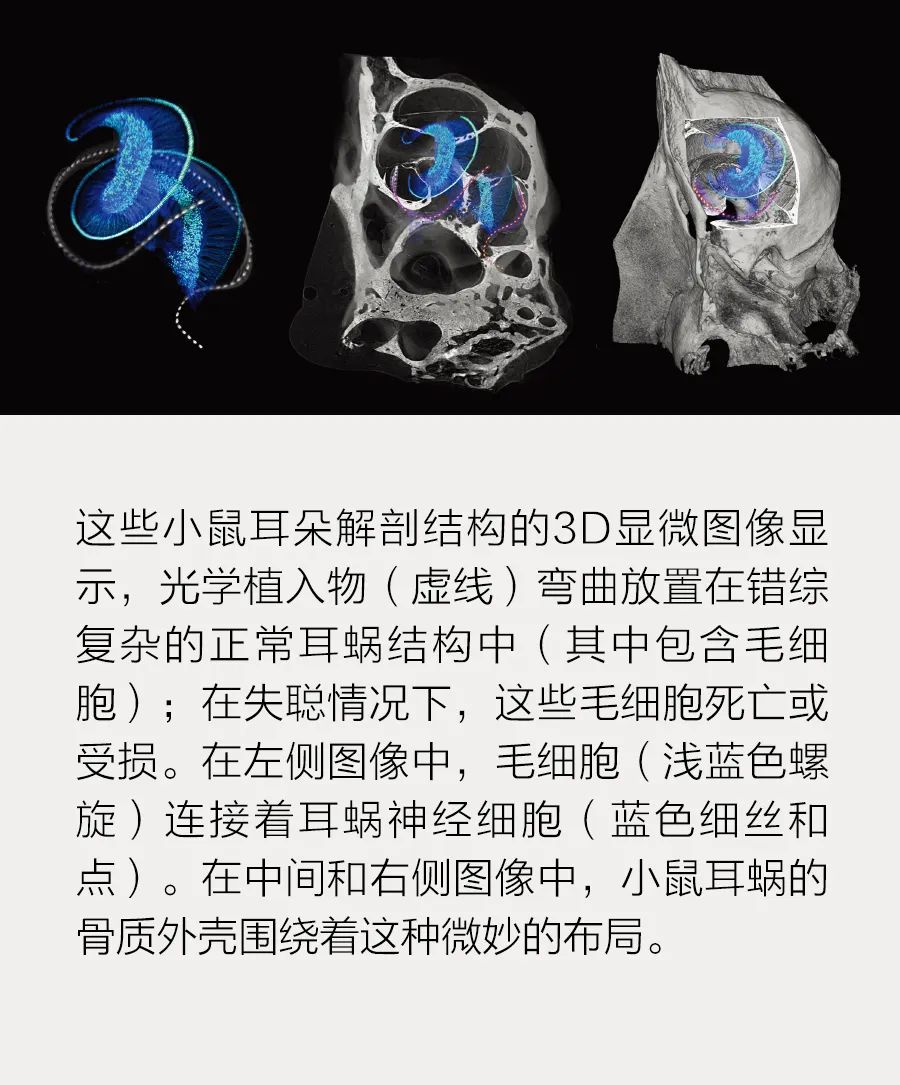
在正常工作的人耳中,声波会沿着耳道向下传播,使鼓膜运动,进而振动中耳里的小骨。这些骨头会将振动传递到内耳的耳蜗——一个豌豆大小的蜗牛状结构。在充满液体的耳蜗内,有一层膜会对声音振动作出反应,产生波纹,这些波纹会移动从该膜表面伸出的感觉毛细胞束。这些运动会触发毛细胞释放神经递质,在耳蜗神经的神经元中产生电信号。所有这些电信号会对声音进行编码,信号通过神经传递到大脑。不管编码的是哪种声音频率,耳蜗神经元都会通过其电信号的频率和时间来表示声音强度,信号频率可以达到几百赫兹,时间可以达到亚毫秒精度。
耳蜗不同部位的毛细胞会对不同频率的声音作出反应,螺旋形耳蜗底部的毛细胞最高可以识别20千赫兹左右的高音,螺旋顶部的毛细胞则可以识别低至20赫兹左右的低音。在神经元一级也有这种耳蜗频率图,我们可以把它们看作一个螺旋阵列的接收器。人工耳蜗就是利用这一结构刺激耳蜗底部的神经元产生高音感知的,以此类推。

如今的商用人工耳蜗包括戴在头上的麦克风、处理器和发射器,以及植入的接收器和电极。耳蜗中通常嵌有12至24个电极,可以在不同点直接刺激神经。但耳蜗内的含盐液体具有导电性,所以来自每个电极的电流会扩散并广泛激活耳蜗频率图上的神经元。电刺激的频率选择性有限,因此人工听力的质量也受到了限制。我们可以把自然听力过程想象成用手指弹钢琴,在这个过程中,毛细胞会触发耳蜗神经上的精确点;人工耳蜗则更像是在用拳头弹奏。更糟糕的是,这种大面积的刺激重叠限制了我们刺激听觉神经的方式,因为它迫使我们一次只能激活一个电极。
长期以来,我一直对声音的编码方式以及这种编码方式在听力障碍情况下是如何出错的很感兴趣。我突然想到,用光而不是电来刺激耳蜗神经可以实现更精确的控制,因为即使在耳蜗的含盐环境中,光也可以准确聚焦。
如果利用光遗传学来使耳蜗神经细胞变得对光敏感,那么我们就可以用低能光束精确地击中这些目标,从而产生比电植入物更精细的听觉感受。理论上,与电植入物的电极数量相比,我们可以在整个耳蜗内设置5倍以上的目标,也许可以多达64个或128个。声音刺激可以通过电子方式被分割成更多的离散频段,给用户带来更丰富的声音体验。早些时候,美国西北大学的克劳斯-彼得•里希特(Claus-Peter Richter)提出了这一总体思路,他建议用高能红外光直接刺激听觉神经,但这一概念没有得到其他实验室的证实。
虽然我们的想法激动人心,但我和我的合作者也看到了许多挑战。我们提出了一种新型植入性医疗设备,它能够与一种新型基因疗法结合,且二者都必须符合最高安全标准。我们需要确定在光遗传学系统中使用的最佳光源,以及如何将它传输到耳蜗中的适当位置。我们必须找到要在耳蜗神经细胞中使用的合适的光敏蛋白,同时找到最佳办法将编码这些蛋白的基因递送到耳蜗的正确位置。
不过,这些年来我们取得了巨大进步。2015年,欧洲研究理事会支持了我们的“OptoHear”(光听)项目,让我们感受到了被信任,2019年,我们独立出来,成立了一家名为OptoGenTech的公司,致力于将我们的设备商业化。
在小鼠身上进行的早期概念验证实验探索了在我们任务中发挥作用的生物学和技术要素。找到合适的光敏蛋白(或称“光敏感通道蛋白”)是一个漫长的过程。许多早期光遗传学研究使用的是光敏感通道蛋白-2(ChR2),它能对蓝光作出反应并打开一个离子通道。我们将其用于一个小鼠概念验证实验,并证明,听觉通路的光遗传学刺激能够实现比电刺激更好的频率选择性。
在继续寻找最佳光敏感通道蛋白的过程中,我们尝试了ChR2的一种变体,叫做“钙转位光敏感通道蛋白”(CatCh),它来自全球光遗传学先驱之一恩斯特•班贝格(Ernst Bamberg)所领导的的马克斯•普朗克生物物理研究所实验室。我们使用了一种无害的病毒作为载体,将CatCh传送至蒙古沙鼠的耳蜗神经元中。接下来,我们训练沙鼠对听觉刺激作出反应,教它们在听到声音时避开特定区域。然后,我们用一种药物杀死了毛细胞,令沙鼠失聪,并嵌入了一个微小的光学耳蜗植入物来刺激对光敏感的耳蜗神经元。这些失聪动物对这种光刺激的反应与对听觉刺激的反应一样。
不过,使用CatCh有两个问题。首先,它需要蓝光,这会涉及光毒性问题。当光线(特别是高能蓝光)直接照射到通常处于身体内部黑暗中的细胞时,这些细胞可能会受损并最终死亡。CatCh的另一个问题是重置速度慢。在体温下,一旦CatCh被光激活,大约需要十几毫秒来关闭通道并为下一次激活做好准备。编码声音需要精确的神经元激活时间(可能需要超过每秒100次尖峰),这种缓慢运动无法实现配合。许多人说,光敏感通道蛋白的慢速运动会导致我们的探索不可能完成,即使实现了光谱分辨率,也会失去时间分辨率。不过,我们把这些疑虑转化为了强劲的动力,去寻找速度更快且可对红光作出反应的光敏感通道蛋白。
得知光遗传学领域的引领者、麻省理工学院的爱德华•博伊登(Edward Boyden)发现了一种作用更快的光敏感通道蛋白(他的团队称之为Chronos)时,我们很激动。虽然Chronos也需要蓝光激活,但它是迄今为止速度最快的光敏感通道蛋白,在室温下3.6毫秒左右就能关闭。更妙的是,我们发现,在更温暖的体温下,大约1毫秒内它就能关闭。然而,要让Chronos在耳蜗中工作还需要一些额外的技巧,我们必须使用强大的病毒载体和某些基因序列来提高Chronos蛋白向耳蜗神经元细胞膜的传递效率。通过这些技巧,单个神经元和神经群体对高达250赫兹的更高频率的光刺激都作出了强有力的反应,并具有良好的时间精度。因此,借助Chronos,我们能够获得接近自然速度的神经放电速率,这意味着我们可以同时实现高频率和时间分辨率。但我们仍需找到一种速度超快并且可以在波长更长的光下工作的光敏感通道蛋白。
我们与班贝格合作共同迎接挑战。这次合作的目标是Chrimson,一种由博伊登首次提出、受橙色光刺激效果最好的光敏感通道蛋白。我们的Chrimson工程实验取得的第一个成果是快速Chrimson(f-Chrimson)和超快速Chrimson(vf-Chrimson)。我们高兴地发现,f-Chrimson能够使耳蜗神经元对红光作出可靠反应,刺激频率可高达约200赫兹。vf-Chrimson比f-Chrimson更快,但在细胞中的表达比f-Chrimson少;到目前为止,vf-Chrimson在耳蜗神经元高频刺激方面没有表现出明显超出f-Chrimson的优势。
在触发光遗传学细胞的植入光源方面,我们也一直在探索各种选择。植入物必须足够小以适应耳蜗内的有限空间,也要足够硬以便于手术插入,同时还要有足够的柔性以适应耳蜗的弧度。其外壳还必须具有生物相容性、透明性和坚固性,能够使用几十年。我的合作者乌尔里希•施瓦茨(Ulrich Schwarz)和帕特里克•卢瑟(Patrick Ruther,当时还在弗赖堡大学)就是从开发第一款用于光学人工耳蜗的微型发光二极管(microLED)开始的。
我们发现microLED很有用,因为这是一项功率效率很高的非常成熟的商业技术。我们用微型薄膜microLED进行了几项实验,证明我们可以在目标频率范围内对耳蜗神经进行光遗传学刺激。但是microLED也有缺点。首先,它很难在被植入的microLED周围实现灵活、透明和耐用的密封;其次,效率最高的microLED会发出蓝光,这就又涉及光毒性问题。因此,我们也在寻找另一条出路。

另一种方法不是将半导体发射器本身放入耳蜗,而是将光源(如激光二极管)置于离耳蜗较远的密封钛壳中。然后通过光纤把光送入耳蜗和光敏神经元。光纤必须具有生物相容性、耐久性和足够的柔韧性以便在耳蜗内蜿蜒,这对于典型的玻璃纤维来说可能颇具挑战。目前也有对柔性聚合物纤维的有趣研究,它们可能具有更好的机械性能,但到目前为止,它们在光传播效率方面还无法与玻璃纤维媲美。光纤方法可能存在效率缺陷,因为光在从激光二极管传输到光纤的过程中,在沿着光纤传输以及从光纤传输到耳蜗时,会出现光损失。但这种方法似乎很有希望,因为它可以确保光电子元件被安全地密封起来,并可能实现柔性波导阵列的轻松插入。

耳蜗植入手术已经相当成熟,通常最多只需要几个小时。为了简单起见,我们希望手术能够尽可能地接近现有手术。但手术的关键部分完全不同:外科医生首先需要使用病毒载体将光敏感通道蛋白的基因传送到耳蜗神经细胞,而不是把电极插入耳蜗中,然后再将光发射器植入耳蜗。
由于研究人员刚刚开始在临床试验中测试光遗传学疗法,对于如何让这项技术在人类身上发挥最佳作用,仍有一些不确定性。我们还在思考如何让病毒载体将必要的基因传送至耳蜗中正确的神经元。到目前为止,我们在实验中使用的病毒载体是一种腺相关病毒,这是一种无害病毒,已经获批用于多种基因疗法,而且我们正在使用一些基因技巧和局部给药办法,专门以耳蜗神经元为靶点。我们已经开始收集数据,了解通过光遗传学改变的细胞的稳定性,以及它们是否需要重复注射光敏感通道蛋白基因以保持对光的反应。
我们有着雄心勃勃的临床试验计划,正在努力最终确定和锁定设备的设计,同时正在动物身上进行临床前研究,以抑制光毒性并证明基本思路的有效性。我们的目标是2026年开始首次人体研究,届时我们将确定最安全的基因疗法剂量。我们希望于2028年启动大规模III期临床试验以收集数据,用于将设备提交监管部门批准,且可能会在21世纪30年代初获得批准。
我们预见的是一个光束可以为听力严重受损或失聪的人带来丰富声景的未来。我们希望,光学人工耳蜗能够帮助他们在杂乱的会议中辨别声音,帮助他们欣赏自己最喜欢的歌曲的微妙之处,并接收到从婉转的鸟鸣到低沉的贝斯声的所有声谱。我们相信这项技术有可能照亮他们的听觉世界。
作者:Tobias Moser
