免疫系统依赖于大量单个细胞-细胞间相互作用事件。这些相互作用是区分自我和非自我的关键,也是新出现的癌症免疫疗法的基础,如免疫检查点封锁、过继性T细胞疗法和癌症疫苗。目前的研究方法主要从细胞群体培养中解析相互作用。尽管群体数据对于表征细胞类型和整体反应之间的协同行为很有作用,但在许多生物系统,特别是免疫系统中,缺乏精确描述细胞相互作用所必需的细节。
微流控技术利用皮升体积的液滴、微腔室或者微孔来定量细胞分泌的细胞因子,或者采用条形码策略来分析DNA、信使RNA和蛋白质等信息。上述方法可以分析数以万计的细胞,然而这些方法产生大量不含细胞的空腔室。虽然这种低效率对于单细胞研究是可以接受的,但是细胞间的相互作用需要特定的组合,而随机生成细胞组合是不切实际的。通过使用微流控配对细胞、打印液滴或光诱导介电泳实现可控的细胞装载,每个腔室可以包含所需特定数量的细胞,大大提高了组合效率。这些方法可以分析成千上万个细胞配对。然而,它们的设计并不适用于复杂的分析系统,如包括数百万T细胞的免疫组库。因此,仍然需要能够快速生成可控细胞组合的技术,用于大规模的细胞相互作用表征。
近期,来自美国的研究人员发表了题为“Characterizing cell interactions at scale with madeto-order droplet ensembles(MODEs)”的文章,在文中描述了一种用于分析细胞间相互作用的高通量技术(MODEs)。其核心创新是将介电电泳液滴分选与液滴的确定性融合集成,从而构建包含试剂、微球和细胞的特定组合的多组分液滴。为了证明方法的实用性,研究人员富集了与癌细胞孵育后激活的CAR-T细胞,并鉴定了相关基因表达。
液滴组装用于研究细胞间相互作用
液滴微流控技术能够高通量实现单细胞分析(如蛋白质组学,基因组学等),但是目前难以拓展到单细胞之外。例如,将两个细胞和检测组分结合在同一个液滴中,来表征细胞间相互作用(图1A)。主要原因在于液滴微流控是依靠随机包裹来构建这样的有序组合,效率较低。MODE组装则可以通过使用介电电泳分选来选择和合并单组分液滴。通过快速灵活的分步、确定性过程来构建多组分液滴,从而克服了低效率的问题(图1A)。除了确定性的组成,MODE液滴与其他方法形成的液滴相同,因此,可以兼容常规的操作,如孵育以允许细胞-细胞相互作用发生(图1B),进一步荧光分析、分选和测序以表征相互作用行为(图1C)。
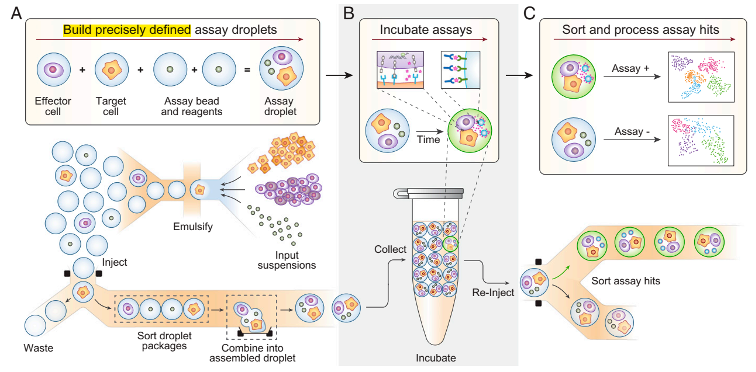
图1 液滴组装用于研究细胞间相互作用
液滴的精确组装
为了评估精确液滴组装的可行性,研究人员生成了含有可控数量荧光微球的液滴(图2A)。通过荧光显微镜评估每个液滴中微球的分布,结果表明编程液滴包含两个、三个、四个或五个微球的精度分别为92%±2.1%、88%±1.0%、78%±3.1%和75%±7.2%(图2A)。虽然组装效率随着微球的增加而降低,但是即使在5颗微球时,该装置的组装效率也可以达到75%,远高于传统基于泊松分布的液滴组装效率。MODE在组装包含不同类型细胞的液滴实验中,为了保证将一定数量的细胞正确分配到组合液滴中,研究人员采用绿色、橙色和红色荧光染料标记不同的Raji细胞,以区分不同的细胞类型,并构建了3000个MODEs,其中每个类型的细胞恰好包含一个(图2B-D)。组装的正确率可以达到82%,缺失一个细胞的比例为10%,包含一个额外的细胞的比例为8%(图2E-2F)。
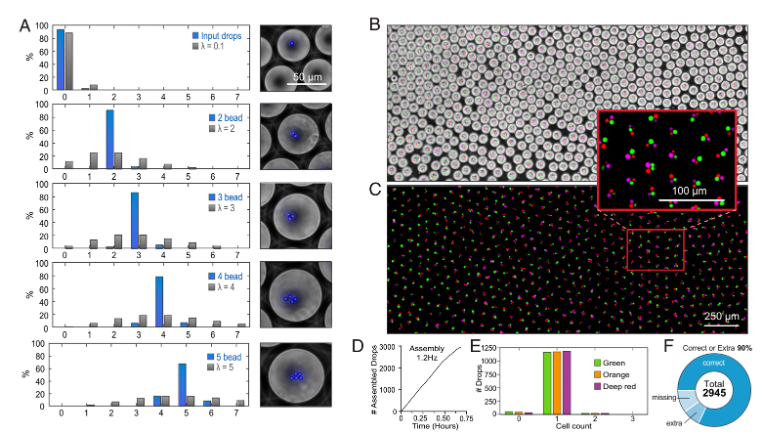
图2 液滴的精确组装
大规模表征CAR-T激活
CAR-T细胞疗法的原理是改造人体的天然T细胞,使其表达一种受体,这种受体能够特异性地识别激活T细胞的癌细胞,并产生免疫反应,治疗疾病。CAR-T工程学的一个重要部分是鉴别能够特异性高效杀死癌细胞的CAR-T细胞。然而,目前实现该目标的bulk细胞方法,无法在单细胞分辨率鉴别具有所需性质的CAR-T细胞,并且成本高昂,需要多轮测试和筛选。相反,MODE组装通过单独测量CAR-T与癌细胞孵育时的激活情况,提供了一种有效鉴别CAR-T的方法。
为了鉴定激活细胞,研究人员首先构建了具有荧光重定位检测体系的MODEs,用于检测分泌干扰素-γ(IFN-γ)。包被有捕获抗体的检测微球用于捕获IFN-γ,IFN-γ被荧光二抗结合后产生富集信号(图3A)。研究人员使用人工刺激的外周血单个核细胞(PBMCs)测试了方法的可行性和通量(图3B)。使用MODE组装,研究人员构建了包含佛波酯13-乙酸酯(PMA)/离子霉素激活PBMC的液滴。结果表明该方法可以实现82%的完整组装精度(图3C和D)。孵育14h后(图3E),将MODE液滴重新注射到液滴分选体系中,发现有17.9%的液滴中分泌IFN-γ(图3F),这与之前PMA/ionomycin刺激PBMC分泌IFN-γ的结果一致。
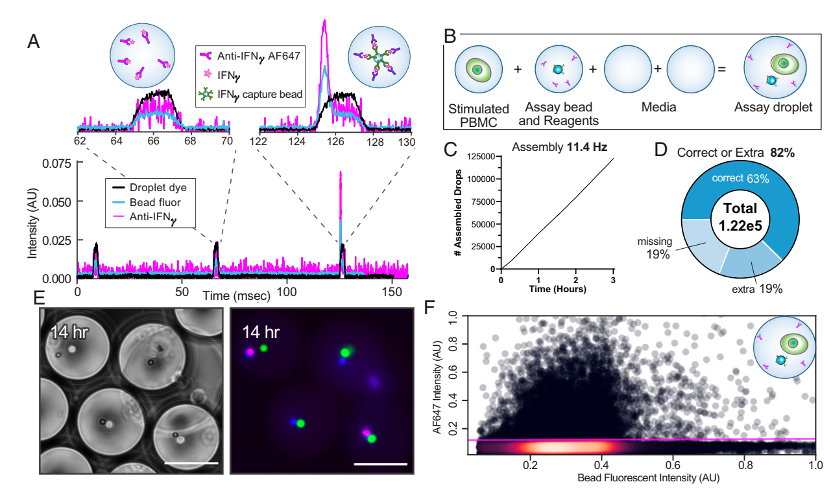
图3 大规模的单个细胞分泌IFN-γ事件分析
研究人员接下来富集与癌细胞相互作用时激活的CAR-T细胞。研究人员组装了16000个MODEs,其中包含CAR-T细胞、Raji细胞、IFN-γ检测微球和检测试剂。另外,研究人员制备了10000个MODEs作为阴性对照,包含两个CAR-T细胞和检测试剂,但没有Raji细胞。孵育14h后,研究人员在CAR-T+Raji MODEs中检测到激活的CAR-T细胞,而在同型对照中没有检测到激活的细胞(图4A-4B)。 为了富集激活的细胞,研究人员根据荧光阈值(图4B)对阳性和阴性液滴进行分选。破乳回收液滴中的内容物,并分析微球的荧光强度,结果表明阳性液滴的信号相对于未分选的液滴有5.5倍富集,相对于弃掉的液滴有18.3倍富集(图4C)。为了揭示激活行为的分子机理,研究人员对分选后收集的细胞和弃掉的细胞进行单细胞RNA测序。比较了两个细胞群之间的整体基因表达后,发现granzyme(GZMB),一种与活化的CD8+ T细胞相关的丝氨酸蛋白酶,在分选群体中显著上调。使用GZMB作为激活的标志,研究人员进一步比较了在分选和弃掉细胞群中,表达GZMB的细胞与在弃掉细胞群中不表达GZMB的细胞,两者的基因表达差异(图4D)。
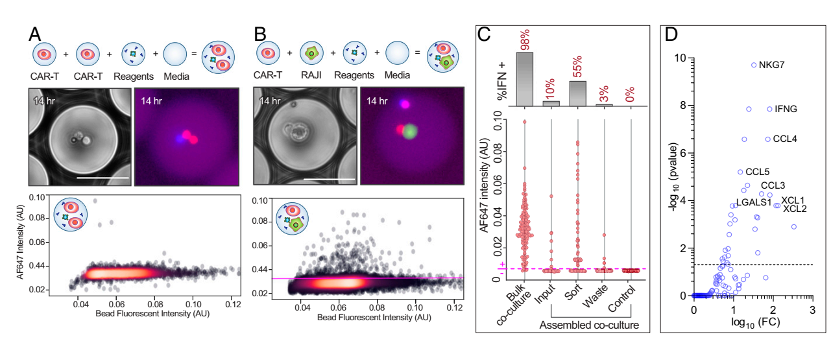
图4 检测CAR-T细胞间相互作用以及富集激活细胞
综上所述,该研究报道了一种用于分析细胞间相互作用的高通量技术,该技术将介电电泳液滴分选与确定性液滴融合集成,从而能够构建包含试剂、微球和细胞的特定组合的多组分液滴。基于该方法,研究人员进一步富集了与癌细胞孵育后激活的CAR-T细胞,并鉴定了相关基因表达,为突破T细胞治疗的瓶颈提供了可选择的方法。
原文链接
https://doi.org/10.1073/pnas.2110867119
延伸阅读:
《微流控初创公司调研》
《肿瘤免疫治疗领域初创公司调研》
