点击左上角“锂电联盟会长”,即可关注!

循环伏安法(CV)

式(9)中:IP为峰值电流;R为理想气体常数;T为温度;v为扫描速度。
CV是目前最常用的电化学技术之一,测定DLi+的操作简单,对于数据处理,只需绘出IP和v1/2的关系曲线,根据式(9)即可求得DLi+。T.T.D.Tran等[1]在研究LiFePO4/C纳米复合电极材料的电化学性能时,基于CV求得DLi+为2.2×10-12cm2/s,与其他文献报道的由CV、GITT和EIS测得的数据一致。
CV法虽能较简易地得到DLi+,但得到的是充放电过程中的平均扩散系数。由于CV过程中浓度变化较大,基于该技术确定扩散系数的可靠性较差。此外,CV只能快速而粗略地估计扩散系数的数量级,因此,很多研究者为了实验的完整性,多采用CV辅助观测氧化还原峰,以研究电化学反应的机理,DLi+则用其他方法,如 EIS计算得出。
C.J.Lyu等[2] 在研究Nb掺杂对一维纳米结构NCM正极材料的影响时,通过CV观察到Nb-NCM的氧化峰和还原峰电位差均小于NCM,证明掺杂Nb可提高库仑效率,缓解电化学极化。通过EIS计算,得出Nb-NCM的DLi+为1.8×10-10cm2/s,大于NCM的1.13×10-12cm2/s,表明Nb掺杂有利于Li+的迁移。
CITT是通过引入电位-电荷容量与电流-电荷容量之比(RPG),在此基础上发展起来的、连续测定DLi+的方法。具体推导如下。
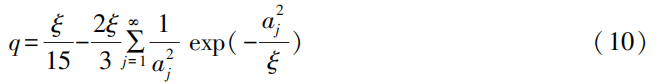
式(10)中:ξ为定义的无因次变量,取值为r2/DLi+tG;tG为恒流充电时间;aj为常数列。
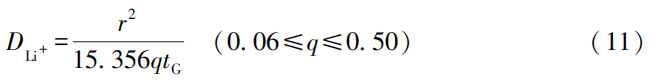
CITT的优势在于数据处理相对简单。其他测试方法需要许多互补的参数,包括活性材料组成、嵌锂量、有效表面积和摩尔体积等,而CITT只要测试出r、q和tG,即可得到DLi+。q和tG可由CITT循环曲线求得,因此只用测定r,即可求得DLi+;CITT还可连续确定不同充电状态和不同循环情况下的DLi+ 。
S.Y.Wang等[3]利用KMnO4控制氧化MnCO3前驱体与锂盐的固相反应,制备LiMn2O4固相微球和壁厚可调节的空心微球,在研究结构对LiMn2O4作为锂离子电池正极材料性能的影响时,通过CITT测得样品LMO-3、LMO-5和LMO-S(LMO-y,y指KMnO4与MnCO3反应的时间,min;S指固相微球)的DLi+在10-11~10-8.5cm2/s数量级,且LMO-3数值最大,证明壁厚较薄的LMO-3的Li+迁移率更高。
王盈来等[4]合成NCM粉末正极材料,利用CITT测得,DLi+随电位和循环次数的不同分布于10-12~10-11.5 cm2/s;电位在3.9~4.3V时,DLi+较为稳定;循环次数越多,DLi+越稳定。事实上,,相比于其他电化学方法,尽管CITT处理数据更简单,但更多的学者仍倾向于使用 EIS、GITT等这些经过实践且更为成熟的方法,因此,CITT 实际运用并不广泛。
参考:周肇国, 徐艳辉. 锂离子电池中Li+扩散系数的测定方法[J]. 电池, 2022, 52(2):5.
[1] Huynh L T N , Tran T T D , Nguyen H H A , et al. Carbon-coated LiFePO4–carbon nanotube electrodes for high-rate Li-ion battery[J]. Journal of Solid State Electrochemistry, 2018.
[2] Cl A , Jing Y A , Yi P A , et al. 1D Nb-doped LiNi 1/3 Co 1/3 Mn 1/3 O 2 nanostructures as excellent cathodes for Li-ion battery[J]. Electrochimica Acta, 2019, 297:258-266.
