具有多根微丝的柔性多通道电极阵列(fMEA)因其机械刚度低而有望为大脑研究做出贡献,从而促进植入式器件的组织相容性并提高长期记录的稳定性。与传统的刚性微电极不同,柔性微电极具有良好的灵活性,可以实现按需植入全脑,适用于各种电生理实验,例如同时采集多个脑区的神经信号。
但是,由于缺乏所需的刚度,将fMEA进行直接植入大脑是不可行的,必须使用其他材料或方法来辅助其植入。注射是一种很有前途的植入方法。然而,目前的注射技术在植入后需要复杂的准备和封装过程,并且大脑容易受到超压的影响。增强性材料在辅助fMEA植入方面很受欢迎。可降解材料,如聚乙二醇(PEG)或丝心蛋白,可以涂在柔性微丝的外部,以暂时增强刚度。植入后,涂层材料可降解并被身体组织吸收。但在很多情况下,增强性材料的刚度不足,增加了植入的难度。另外,增强性材料的降解和吸收需要较长时间,可能导致毒性。另一种常用的方法是使用刚性穿梭探针或微针将fMEA插入皮层。但是,fMEA上通常有不止一个微丝。在这种情况下,需要复杂的手动操作来单独对齐和固定梭探头上的柔性柄。另一种选择是同时将多个微丝与相同数量的穿梭探针对齐并将它们粘合在一起。然而,随着微丝数量的增加,目前的操作方法无法保障有效和安全地植入。
据麦姆斯咨询报道,来自中国科学院半导体研究所,集成光电子学国家重点实验室的裴为华团队及相关合作单位共同开发了一种改良fMEA的潜在解决方案,相关研究成果以“Distributed
implantation of a flexible microelectrode array for neural
recording”为题发表在Nature旗下期刊Microsystems & Nanoengineering。
在该研究中,为获得简单实用的植入方法,研究人员自制植入工具,结合植入微丝前端的导向环,可以半自动拾取并植入单个fMEA微丝。fMEA中每个微丝的位置和深度可以使用此工具进行控制。这种方法减少了人工操作,同时提高了植入精度和速度。为了减少采用扇出方法封装插头插座后fMEA的体积,研究人员提出了一种直接互连方法,即利用位于fMEA连接器部分具有特殊设计的焊盘以及改良的金球键合工艺,将fMEA和放大器连接起来。这种方法不需要成对的插头插座连接器,从而为开发具有多个微丝和记录位点的fMEA提供了有效的解决方案。
考虑到其出色的生物相容性和柔韧性,研究人员选用聚酰亚胺(PI)2600系列作为fMEA的柔性基底,并将fMEA设计为典型的PI-金属-PI三明治结构(图1)。具体来看,fMEA有四个微丝,微丝的长度约为2.5 cm,可以使得半自动植入平台植入大鼠大脑的任何区域;而其宽度仅为70 μm,以最大限度地减少植入部分的体积;且其前端的环被制成手柄以辅助植入。另外,每个微丝上有八个记录位点,各长10 μm,以100 μm为间隔,沿微丝排列成一条直线。为确保微丝在操作过程中具有足够的机械强度来承受夹紧、拖曳和拉扯,研究人员选择了抗拉强度为350 MPa的聚酰亚胺为制作材料。
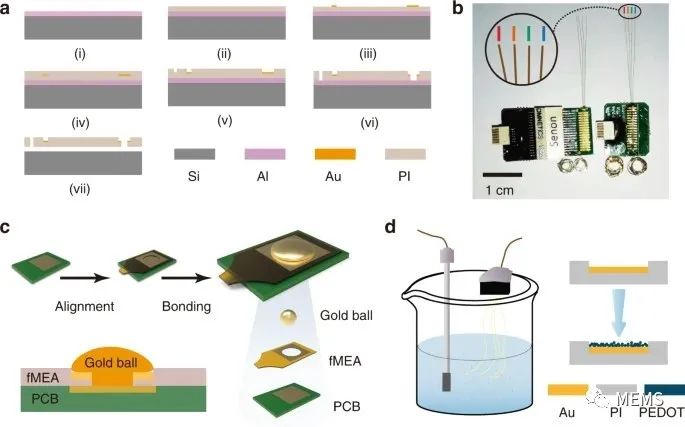
图1 柔性微电极的制备
为确保信号质量并减少外部引线的数量,研究人员采用放大器模块来执行神经信号的采集、放大、数字化和复用,并使用改良的金球键合工艺将fMEA连接到放大器模块。该模块的体积不到带有Omnetics连接器的传统封装微电极体积的一半。基于金球键合的小尺寸集成封装方案,操作简单,可将fMEA通道扩展至数百或更多。
在进一步的研究中,研究人员对fMEA进行了阻抗测试和微观形貌观察。聚(3,4-乙烯二氧噻吩)(PEDOT)通常用于修饰记录位点以提高阻抗和稳定性,研究人员通过使用含有0.02 M
EDOT单体和0.1 M
TsONa(对甲苯磺酸钠)电解质的水溶液进行恒电流聚合,从而在记录位点上生成PEDOT,并在电镀前后在PBS溶液中测量电化学阻抗谱。测量发现(图2),电镀后fMEA界面阻抗降低了一个数量级。共聚焦激光扫描显微镜(CLSM)观察表明,电镀后记录界面的颜色从黄色变为较深,用扫描电子显微镜(SEM)观察记录界面的表面形态和微观结构,结果显示,金界面表面比较平坦,平均粗糙度约为78 nm;而PEDOT界面表面比较粗糙,平均粗糙度约为233 nm,其粗糙度与表面活性相结合,降低了fMEA的电化学阻抗。
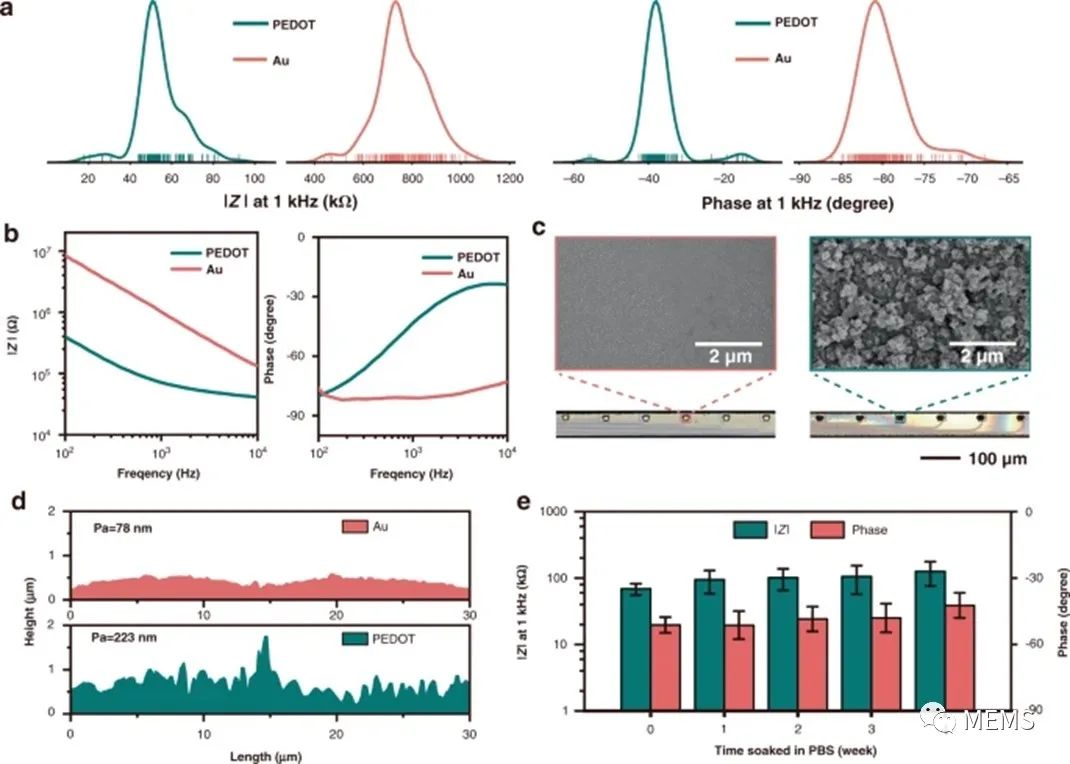
图2 体外柔性微电极的表征
接着,研究人员为柔性微电极的分布式植入构建了一个半自动植入平台(图3)。此植入平台由三个子系统组成,包括三轴定位系统、微丝拾取和插入模块以及观察系统。由刚性微针和支架组成的微丝拾取和插入模块,以及观察系统被共同安装在由计算机控制的三轴定位系统上,从而可以精确移动和定位。构成微丝拾取和插入模块的微针尖端呈T形,可在植入前钩住微丝,并在植入后将其移除,而支架是L形的,以辅助微针控制植入的微丝。另外,观察系统包含两个显微镜,分别放置在微丝拾取和插入系统的两侧,以约45°角对准微针尖端,从而帮助操作人员灵活选择植入位置,以有效避开脑面部血管。
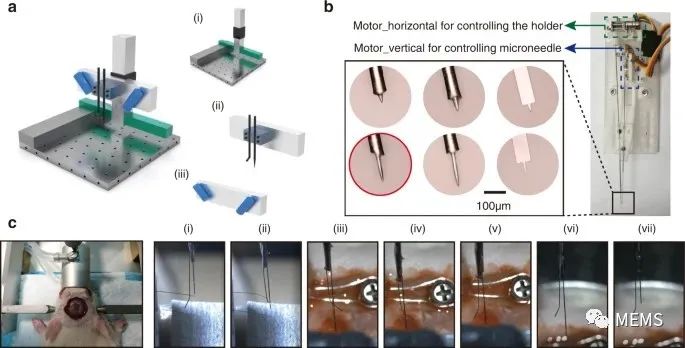
图3 柔性微电极的植入
而后,具体的植入操作可以通过半自动植入平台轻松完成。首先,拾取并移动微丝,直到其与大鼠大脑皮层表面接触。然后,将微丝以每秒约50 μm的速度垂直植入。随着微丝接近目标区域,注入速率降低到每秒10 μm。在22次植入操作中,所有拾取、转移和定位动作均以微米级精度进行。此次研究过程中,研究人员成功植入了20根微丝,而由于未能将微丝与植入微针分离,有两例植入失败。总体来看,每根微丝的平均拾取定位时间小于1 min,成功率达到90%。
最后,研究人员对植入fMEA后大鼠的电生理信号进行了记录和分析。将五个微电极(m1-m5)分别植入五只大鼠大脑不同区域。微电极m1和m2被植入海马CA1区域,而微电极(m3-m5)被植入CPu(尾状壳核)和PrL(前肢皮质)区域。不幸的是,由于大鼠在手术后体温过低而死亡,因此不得不丢弃微电极m5。植入微电极后,使用Neurostudio信号采集软件,以30 kHz的采样率获取神经信号,并使用MATLAB进行数据处理。如图4所示,其信噪比(SNR)高达19 dB,为进一步评估微电极在体内的长期稳定性,研究人员记录了7周的细胞外信号,结果显示,7周后信号振幅减小,然而尖峰仍然清晰可辨。
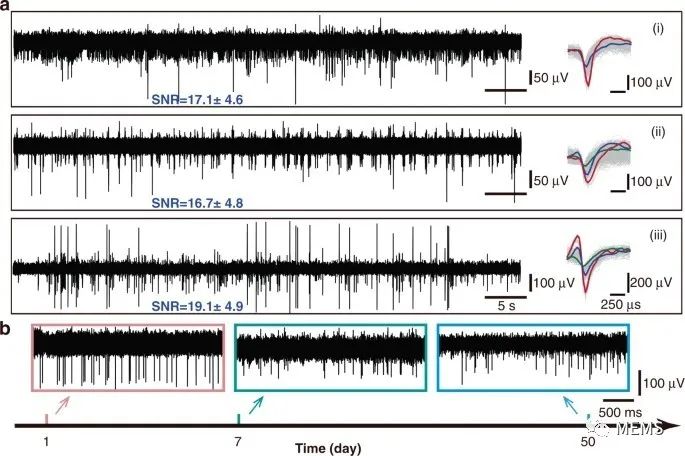
图4 大鼠的细胞外信号
总体而言,研究人员开发了一种半自动柔性微电极植入系统,可以进行fMEA植入而不需要费力的人工操作,整个过程简单快捷。并且,每个微丝可以单独植入,并灵活选择植入位置,以避开脑面部血管。这种植入方法具备良好的重复性,并可以按比例放大以植入具有数百或数千个通道的柔性微电极。此外,研究中所提出的金球键合方法实现了fMEA和芯片的集成,最大限度地减小了器件的尺寸和重量,使整个系统只需几条电源线和数据线即可运行。
论文链接:
https://doi.org/10.1038/s41378-022-00366-2
延伸阅读:
《印刷和柔性传感器技术及市场-2021版》
《柔性、印刷及薄膜电池技术和市场趋势-2020版》
《柔性混合电子(FHE):应用、挑战及创新趋势-2020版》