可穿戴汗液传感器在人体健康及疾病相关的临床信息中发挥着重要的作用。但由于该传感器主要依靠酶和抗体来实现应激生物标志物的特定量化,而酶和抗体易降解,最终会影响传感器,使其性能不佳。据麦姆斯咨询报道,Umesha Mogera和美国德克萨斯农工大学(Texas A&M University)的生物医学工程科学家开发了一种可穿戴等离子体纸基微流控系统,该系统可同时且连续分析汗液流失量、流失速度,以及该代谢产物的成分。该研究成果发表在《科学进展》(Science Advances)期刊上。该科研团队开发的基于无标记表面增强拉曼光谱(SERS)的等离子体传感器,为分析物识别提供化学指纹。他们展示了在生理和病理状态下汗液中尿酸的检测灵敏度,该微流控系统还有助于对有意义的参数进行准确定量。他们设计的可穿戴等离子体器件具有柔软、有弹性且可伸缩的性质,可直接接触皮肤,而无化学或物理刺激。
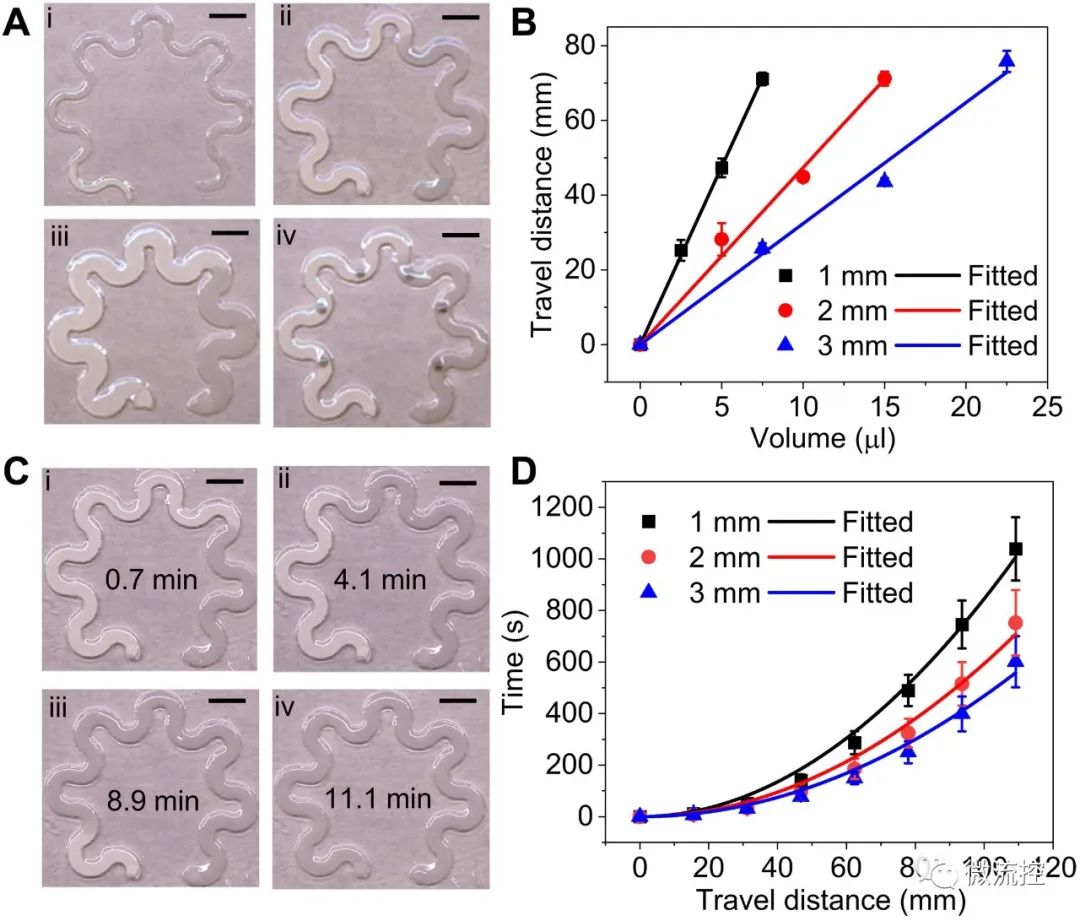
纸基微流控器件的流动特性:(A)不同纸张通道宽度((i)1毫米宽;(ii)2毫米宽;(iii)3毫米宽)的蛇形纸基微流控器件,以及(iv)2毫米通道宽集成等离子体传感器的蛇形纸基微流控器件,在10微升水经过同等时间的不同流动距离;(B)液体流动距离与输入液体体积成一定比例的函数;(C)经过0.7分钟直到11.1分钟,2毫米宽纸基微流控器件中液体流动距离随时间的推移而变化;(D)不同通道宽度下,纸基微流控中液体流动距离与时间的关系。实线为实验数据(点)的拟合曲线。(注:图中比例尺:5毫米)
检测尿酸以进行疾病管理
材料科学家已经开发出一系列生理传感器,用于连续测量物理和化学生物标志物,应用于疾病诊断、健康监测和个性化医疗。可穿戴汗液传感器可以检测汗液中的各种化学物质,包括电解质、代谢物、重金属、药物和激素等,以了解它们对人体的生理及病理性影响。汗液中氯化物浓度可以为囊性纤维化提供标准的诊断筛查参数,而汗液中葡萄糖的定量检测则可用于糖尿病管理。同样,尿酸也是心肾疾病和2型糖尿病的生物标志物。可穿戴汗液传感器通常需要在高度灵敏且稳定的环境中才能准确量化生物标志物。在这项研究中,Umesha Mogera及其团队引入了一种可穿戴等离子体纸基微流控(或叫“纸流控”)系统,可以直接捕获汗液,以实时连续、可靠地量化汗液流失量、流失速度和汗液中的分析物。该科研团队基于集成等离子体的纳米传感器,使用表面增强拉曼光谱来量化在人体生理和病理状态下的尿酸浓度。该团队还展示了结合超薄、柔软和有弹性的等离子体纸基微流控器件的工作模式,以量化不同浓度的分析物。
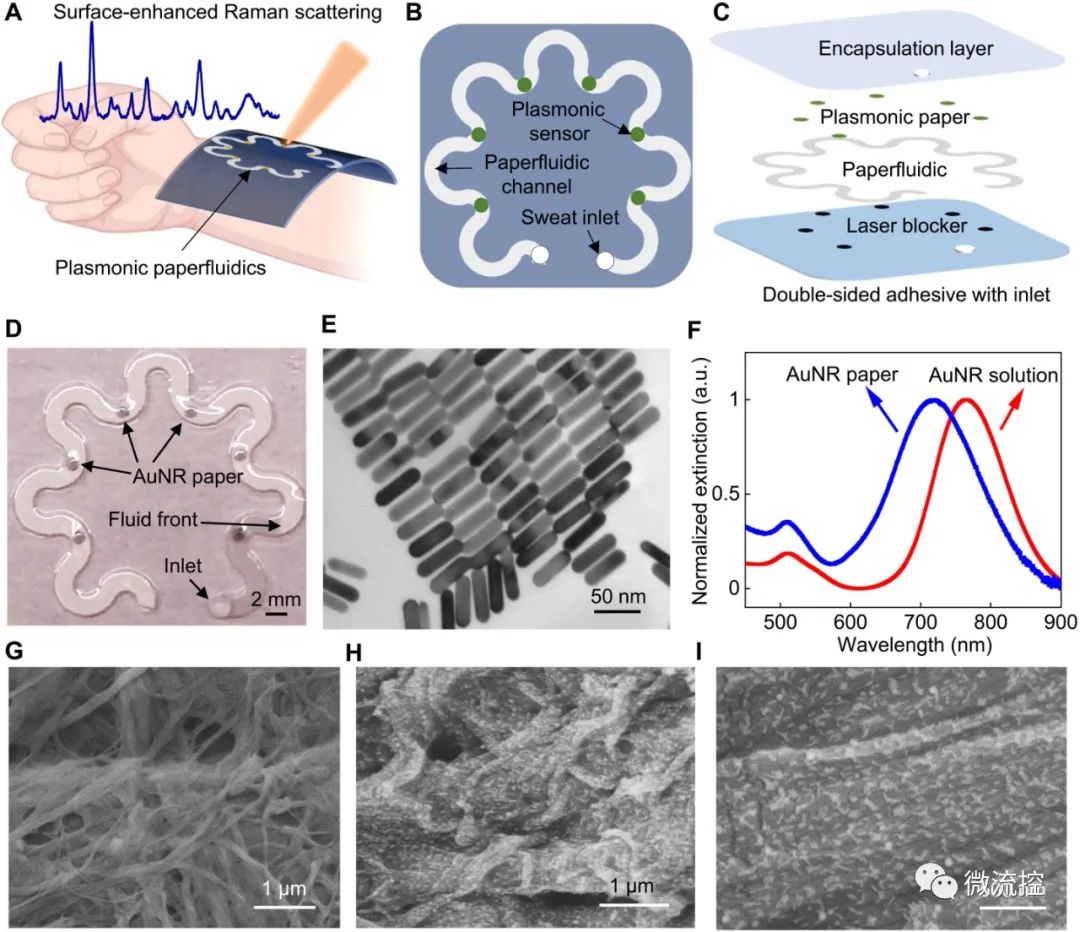
可穿戴等离子体纸基微流控器件:(A)利用表面增强拉曼光谱技术进行汗液收集、储存和原位分析的可穿戴等离子体纸基微流控器件的概念图;(B)突出关键功能层的纸基微流控器件俯视图和(C)堆叠视图;(D)装配有六个等离子体传感器的纸基微流控器件;(E)尺寸分布均匀的金纳米棒的TEM图像;(F)金纳米棒溶液和金纳米棒纸的消光光谱;原始色谱纸(G)和金纳米棒纸(H、I)的SEM图像。
可穿戴等离子体纸基微流控器件的设计
Umesha Mogera及其团队开发了一种柔软、超薄的层压式纸基微流控器件,用于人体手腕处的汗液收集、运输、储存,以便使用便携式拉曼光谱仪进行实时、无标记的生化分析。该器件具有多个功能层优势,包括双面粘合剂、激光阻挡纸基微流控层、等离子体传感器和封装层。该团队使用了一种蛇形设计的纤维素色谱纸,作为有效的微流控通道,在没有外力或入口压力的情况下,将排出的汗液通过多孔介质输送出去。蛇形设计促进了该器件的灵活性和可拉伸性,以适应皮肤的正常活动,而不会产生界面应力或引起器件退化。利用安装在纸基微流控通道不同位置的等离子体传感器,研究人员使用拉曼光谱量化了不同时间点汗液中分析物的浓度。值得注意的是,在原位拉曼光谱测量期间,黑碳双面粘合剂可阻止激光损伤皮肤,避免其对皮肤的刺激。该团队在纸基微流控器件中添加了一滴10微升的水,并让液体在一分钟内通过第一个等离子体传感器。对于等离子体传感器,他们使用了吸附有金纳米棒(科研团队合成的AUNR)的色谱纸,并通过静电相互作用和范德华力促使其停留在纸上。
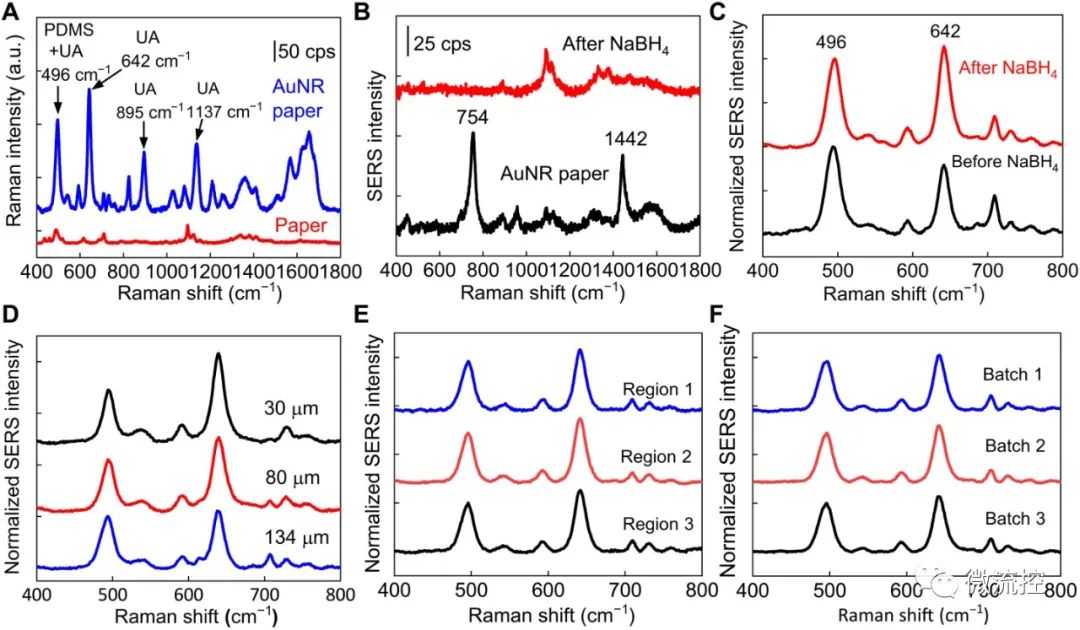
等离子体传感器的优化:(A)在原始纸和金纳米棒纸上收集的用1倍磷酸缓冲盐溶液(PBS)稀释的100微摩尔尿酸的拉曼光谱;(B)用硼氢化钠(NaBH4)从金纳米棒中去除表面活性剂前后的金纳米棒纸的拉曼光谱,和从金纳米棒纸上收集的尿酸的相应的表面增强拉曼光谱(C);(D)具有不同厚度的PDMS(聚二甲基硅氧烷)封装层的100微摩尔尿酸的表面增强拉曼光谱。从同一批次不同区域的金纳米棒纸(E)和不同批次的金纳米棒纸(F)收集的100微摩尔尿酸的表面增强拉曼光谱。
纸基微流控器件的流动特性、等离子体优化和灵敏度
接下来,该科研团队通过夹在由聚二甲基硅氧烷(PDMS)制成的顶部封装层和底部粘合剂层之间的微流控蛇形纸的流动特性来量化出汗量和出汗速度。对于给定厚度的纸张,液体吸收体积与纸张宽度和液体流动距离成线性比例。科学家们对微流控纸的液体动力学进行了表征,以实时量化出汗率,并量化汗液量及出汗速度,这主要取决于该器件贴合于人体的位置。Umesha Mogera及其团队设计并表征了夹在微流控纸和PDMS之间的金纳米棒纸,用于通过表面增强拉曼光谱对尿酸进行高灵敏度检测。该浓度范围为健康人汗液中的生理和病理浓度,以及痛风和高尿酸血症患者的汗液浓度。他们强调了尿酸浓度变化后强度的变化,以确认该器件量化随时间变化的尿酸浓度的能力。
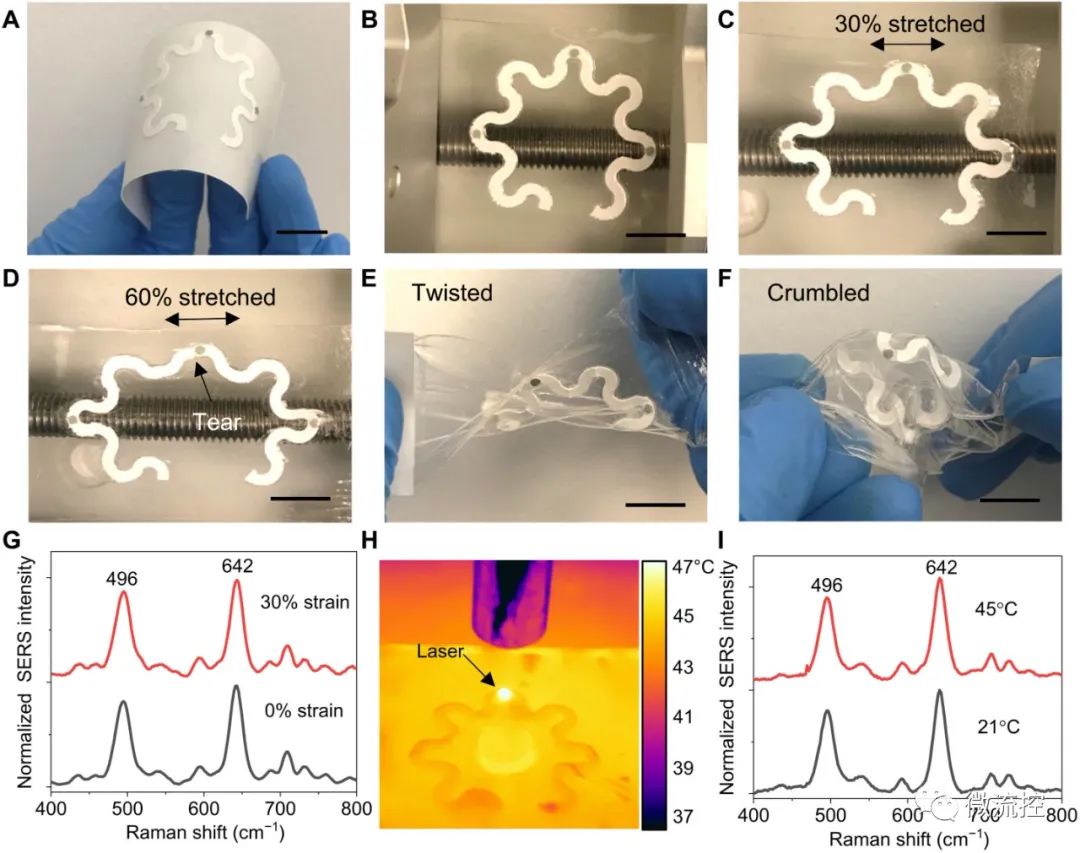
等离子体纸基微流控器件的柔韧性、延展性和稳定性:(A)组装在医用粘合剂上的带有纸衬垫的等离子体纸基微流控器件;(B)在静止状态下安装在机械可拉伸机上的悬空纸基微流控器件;(C)30%拉伸;(D)60%拉伸;(E)扭曲的纸基微流控器件;(F)破碎的纸基微流控器件;(G)在0%和30%拉伸下收集的尿酸的表面增强拉曼光谱光谱;(H)打开激光,放置在45°C热板上的纸基微流控器件红外热图像;(I)在21°和45°C条件下收集的100微摩尔尿酸的表面增强拉曼光谱。(注:图中比例尺:1厘米)
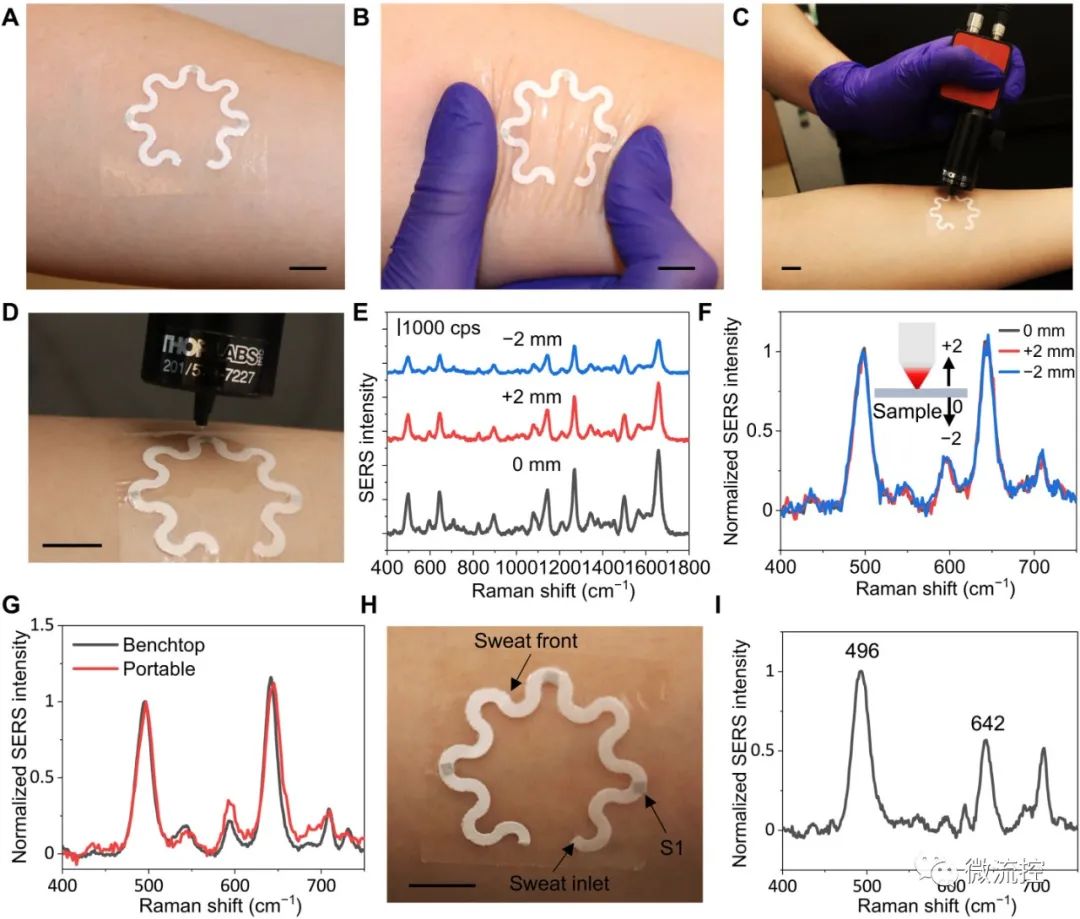
应用演示:(A)粘贴在受试者前臂上的纸基微流控器件;(B)变形的纸基微流控器件;(C、D)带有柔性光纤探头的便携式拉曼光谱仪用于光谱收集;光谱归一化前(E)和归一化后(F)100微摩尔尿酸的表面增强拉曼光谱随激光源与等离子体传感器距离的变化而变化;(G)使用台式及便携式光谱仪收集的表面增强拉曼光谱的比较;(H)一个身体健康的受试者佩戴该器件运动20分钟后的照片;(I)从(H)中的传感器S1区域收集的汗液的表面增强拉曼光谱光谱。(注:图中比例尺:1厘米)
概念验证和前景
柔软超薄的可拉伸双面粘合剂和PDMS封装的纸基微流控器件提供了一个具有稳定组装功能的柔性平台,可承受机械变形和温度变化。为了证明这一概念,研究人员在健康人体上测试了纸基微流控器件收集和分析汗液的性能。得益于其柔软的机械构造,受试者可以在身体的任何部位轻松佩戴该器件。该团队测定了健康人体28微摩尔汗液的浓度。通过这种方式,Umesha Mogera及其同事建立了一个可穿戴的等离子体纸基微流控平台,来收集汗液,运输、储存并进行实时、无标记的生化分析。表面增强拉曼光谱提供了汗液代谢物的化学指纹,但不包含任何生物识别元素。该团队使用该器件测量灵敏度,并量化低至1微摩尔的尿酸浓度。他们展望微型可穿戴光学读出系统未来的发展,将推动等离子体传感器进入疾病诊断和健康监测方面的实际应用。
论文链接:
https://www.science.org/doi/10.1126/sciadv.abn1736
延伸阅读:
《给药应用的微针专利态势分析-2020版》
《微流控初创公司调研》
《电子皮肤贴片技术及市场-2021版》
《印刷和柔性传感器技术及市场-2021版》
《可穿戴技术及市场-2021版》
《医疗柔性电子技术及市场趋势-2020版》
