从某种程度上来说,这是一个家庭的故事。彼得•科瓦切夫(Peter Kovatchev)是一名海军工程师,他把儿子鲍里斯(Boris)培养成了一位擅于解决问题的人,并与孙女安娜(Anna)一起造了好几艘模型船。但他患有糖尿病,他的胰腺无法分泌足够的胰岛素。为了控制血液中的葡萄糖浓度,他每天必须用保存在家中冰箱里的小金属盒内的注射器注射几次胰岛素。然而,尽管已经努力在恰当的时间注射适量的胰岛素,但他的血糖水平还是控制得很差。2002年他因糖尿病并发症去世。鲍里斯现在从事胰腺生物工程替代物的研究;安娜是一名作家和设计师。需要胰岛素的人如履薄冰。血糖浓度会发生显著波动,饮食和运动的影响尤其大。如果血糖浓度降得太低,患者可能会晕倒;如果升得太高并保持太长时间,患者可能会陷入昏迷。为了避免反复出现低血糖,过去患者通常会将血糖控制在较高水平,却容易引发长期并发症,如神经损伤、失明和心脏病。此外,患者还需要持续观察自己的血糖水平,每天要在手指上刺几滴血来测量很多次。这可能是要求患者对自己进行的最苛刻的治疗。不过,这种情况即将成为过去,人工胰腺终于出现了。这种机器可以感知血糖变化,并引导胰岛素泵调整胰岛素输注量,其工作方式类似于连接空调系统、控制室内温度的恒温器。所有商用人工胰腺系统仍然是“混合型”的,这意味着用户需要在进餐时估算食物的碳水化合物量,从而帮助系统控制血糖。尽管如此,人工胰腺仍然是生物技术的一种胜利。这也是希望的胜利。我们清楚地记得2005年12月底的一个上午,糖尿病技术和生物工程专家齐聚位于马里兰州贝塞斯达的美国国立卫生研究院的李斯特山礼堂。那时的技术能够让糖尿病患者得以跟踪其血糖水平,并利用这些读数来估算所需的胰岛素量,而其中问题是如何从中排除人为干预。一位杰出的科学家走上讲台解释道,生物学的葡萄糖调节机制过于复杂,人工无法复制。我们不同意,而且经过14年的研究,我们可以证明这位科学家错了。
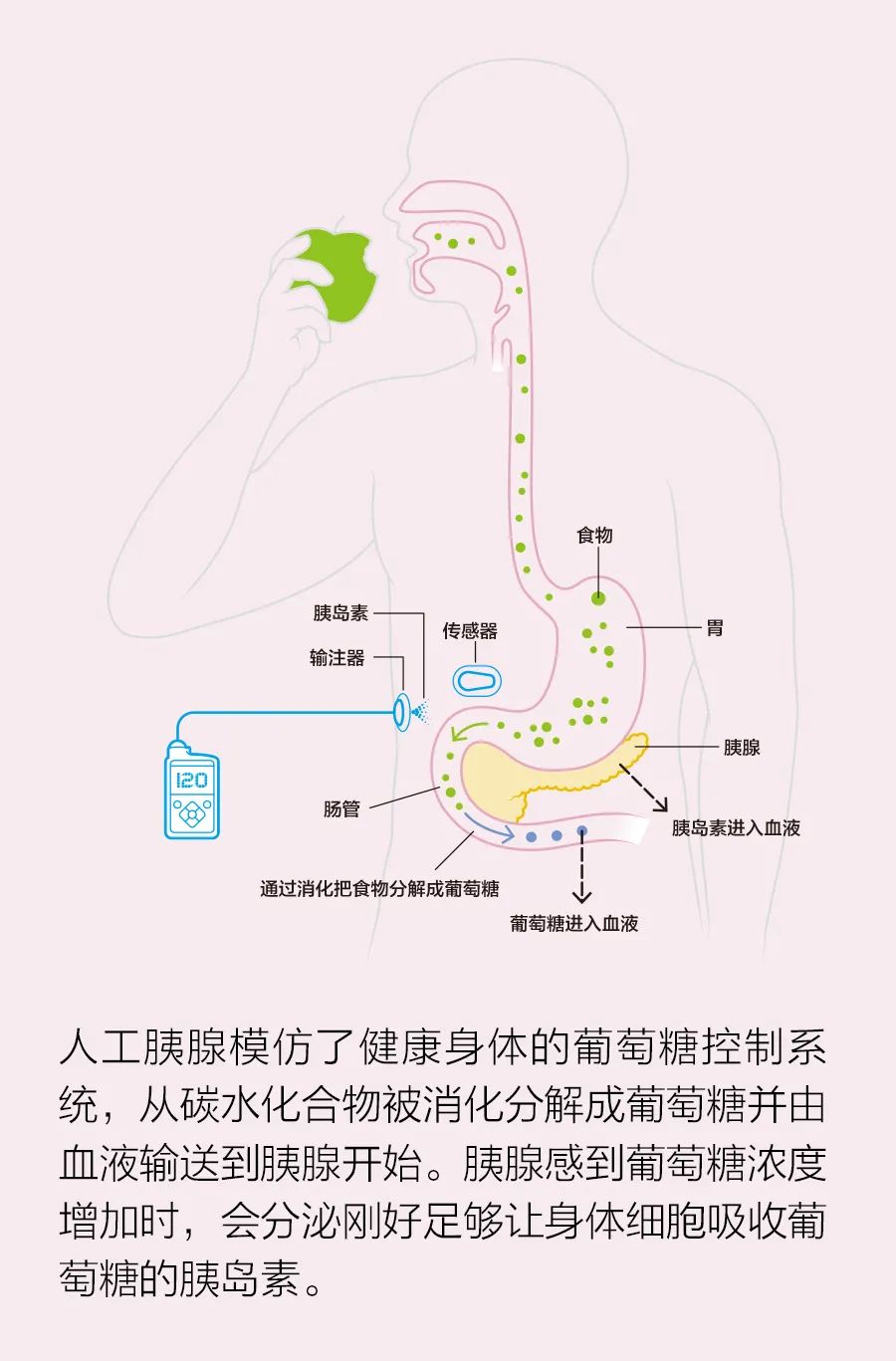
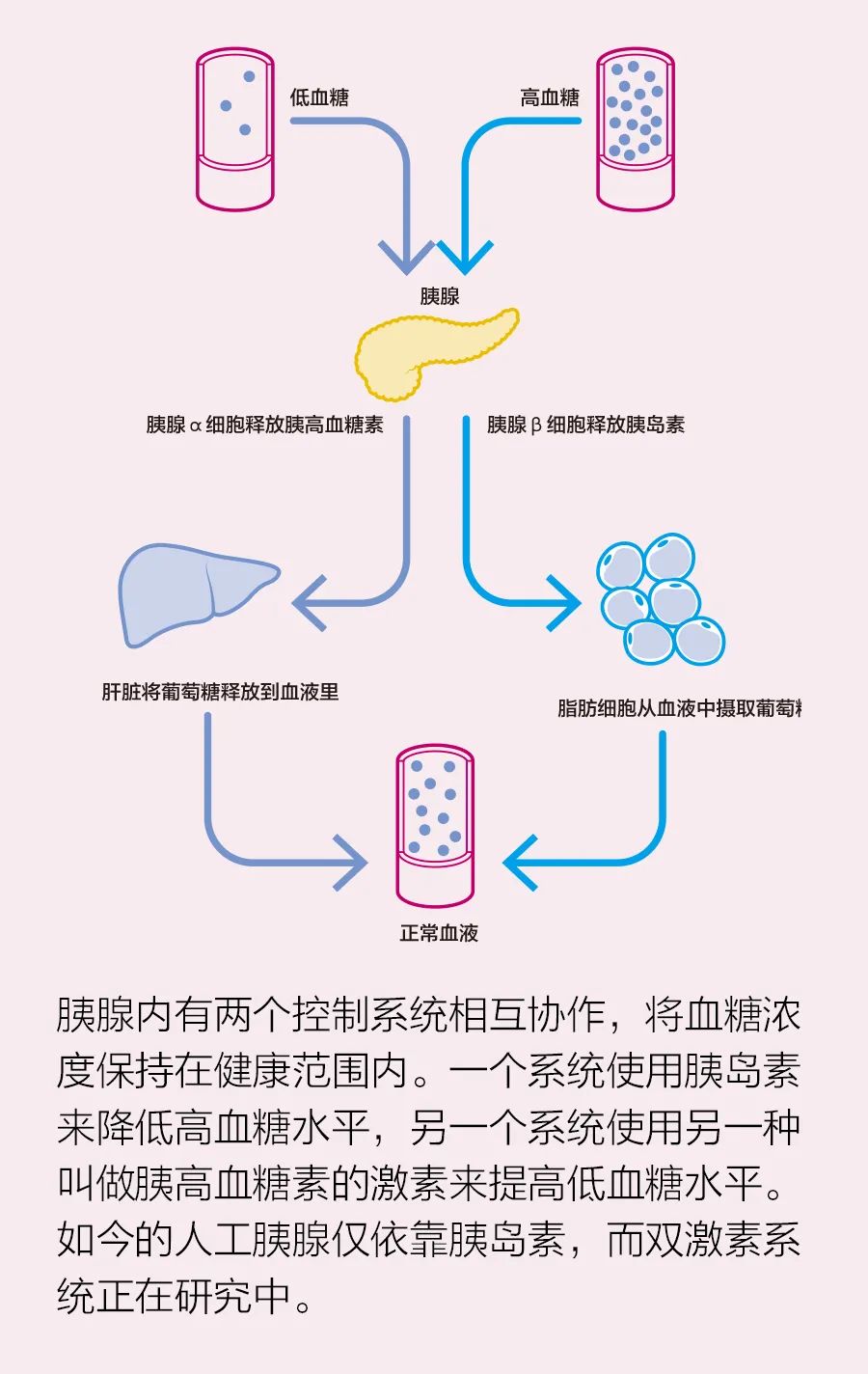
这又一次证实了克拉克第一定律:“如果一位德高望重的杰出科学家表示某件事情是可能的,那他可能是正确的;但如果他说某件事情是不可能的,他很可能是错误的。”在健康的内分泌系统中,空腹血糖水平约为80~100毫克/分升(mg/dL)。普通成年人的整个血液供给中含有4到5克糖,大约相当于餐馆随咖啡提供的小纸袋包装中的糖。无论是以纯糖形式还是淀粉(如面包)形式摄入碳水化合物,都会导致血糖水平升高。功能正常的胰腺能够识别突然摄入的糖分,并分泌胰岛素,让身体细胞吸收它,将它用作能量或储存起来以供后续使用。这一过程会使血糖水平恢复正常。
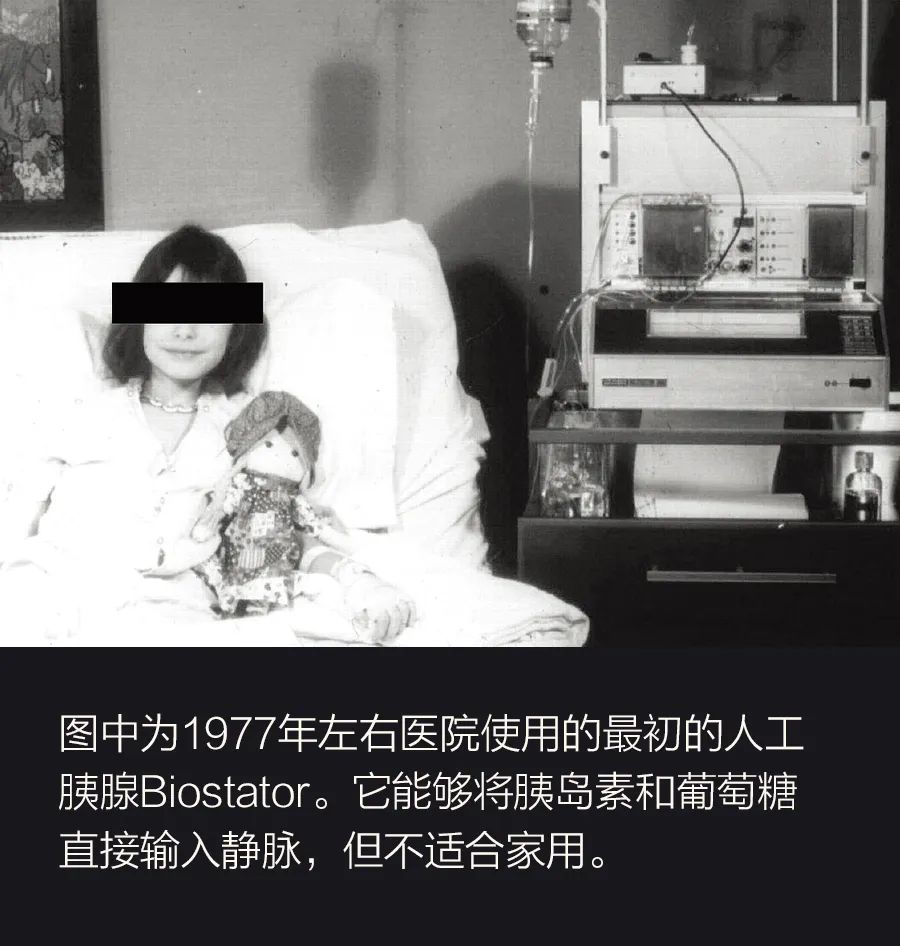
然而,1型糖尿病或需要胰岛素的2型糖尿病患者(仅在美国就有近850万人)的胰腺要么不分泌胰岛素,要么分泌的胰岛素太少,控制过程必须通过人工方法估算。早期,这种估算非常粗糙。1922年,加拿大首次分离出胰岛素并应用于糖尿病患者;此后几十年,注射器一直是治疗糖尿病的主要工具。当时的患者由于无法直接测量血糖,所以不得不检测尿液,而尿液中的糖量只能证明血糖已经上升到非常高的水平。直到1970年,人们才能进行动态血糖检测;1980年,这种检测实现了商业化。经过化学处理的试纸能够与血滴中的葡萄糖发生反应,试纸颜色会随葡萄糖浓度的变化而变化。最后,人们发明了配备二极管和光学传感器的仪器来更精准地读取试纸结果。如果说第一项改进是血糖测量方式;那么第二项则是胰岛素的给药方式。第一台胰岛素泵需要像背包一样佩戴,不适合日常使用,但它为20世纪70年代开始出现的所有其他静脉血糖控制设计铺平了道路。第一个商用“人工胰腺”是一台计划在医院使用的冰箱大小的机器,名为生物监控器(Biostator)。然而,它的体积庞大,而且需要将胰岛素直接注入静脉,因此只能停留在医院实验阶段。在那十年里,人们还开发了更先进的胰岛素输送工具:通过皮下针头持续注入胰岛素的胰岛素泵。20世纪70年代末,迪恩•卡门(Dean Kamen)的AutoSyringe公司推出了第一台这种商用泵,但患者仍然需要通过扎手指定期测量血糖来调整输注量。
之后患者一直依赖这种方法。最后,美敦力公司于1999年推出了第一款可供门诊使用的便携式连续血糖监测仪。用针头将一个薄电极嵌入皮下,然后与身上佩戴的显示器相连。很快,雅培和德康推出了可以实时显示血糖数据的设备。在过去20年里,这种仪器的准确性一直在提高,正是由于这些进步,人工胰腺才成为可能。我们的最终目标是复制胰腺控制系统的所有工作,这样患者就不必再自己照顾自己了,但事实证明,模仿健康的胰腺极其困难。
从根本上说,血糖管理是一个优化问题,受到饮食、运动、疾病和其他可能影响新陈代谢的外部因素的综合影响。1979年,生物医学工程师理查德•伯格曼(Richard Bergman)和克劳迪奥•科贝利(Claudio Cobelli)提出了解决这个问题的基础,他们将人类代谢系统表达为了一系列方程式。然而,在实践中,由于3方面的主要原因,人们很难找到解决方案:
胰岛素作用延迟:在体内,胰岛素由胰腺分泌并直接分流到血液中。从皮下注射时,即使是最快的胰岛素也需要40分钟到1小时才能达到作用峰值。因此,人工胰腺控制器必须提前1小时规划降低血糖并预测未来的情况。不一致性:人与人之间的胰岛素作用不同,甚至同一个人不同时间的胰岛素作用也不同。传感器不准确:即使是最好的连续血糖监测仪也会出错,有时会朝某个方向偏移,显示血糖水平过低或过高,而这一问题可能会持续数小时。更重要的是,该系统必须考虑复杂的外部影响,这样才能对一个整天坐在书桌旁的中年人和一个站在滑雪板上从山坡飞驰而下的青少年同样有效。为了克服这些问题,研究人员提出了各种解决方案。第一种尝试是一个简单的比例积分微分(PID)控制器,其中胰岛素的输送与血糖水平的上升及其变化率成正比。美敦力的一个商用系统仍在使用这种方法,并经过多次算法改进调整了PID对皮下胰岛素输送速度的反应。另一种预测控制算法更加复杂,它使用的是人体代谢系统模型,如伯格曼和科贝利在1979年提出的模型。它主要是预测未来状态,从而部分补偿皮下胰岛素延迟扩散到血液中所产生的影响。还有一种实验控制器使用了两种激素,即使用胰岛素来降低血糖水平,使用胰高血糖素来提高血糖水平。每一种方法的建模工作都为制造人工胰腺创造了概念背景。下一步就是实际制造人工胰腺。要设计控制器,我们必须有测试它的方法,生物医学工程通常依靠动物试验,但这种测试既耗时又昂贵。2007年,我们在弗吉尼亚大学的团队提出了使用计算机模拟试验来代替。
我们和意大利帕多瓦大学的同事一起搭建了一个葡萄糖-胰岛素动力学计算机模型,在300位患有1型糖尿病的虚拟受试者身上进行了操作。我们的模型通过微分方程描述了葡萄糖和胰岛素的相互作用随时间的变化,这些微分方程表示了目前能实现的对人类生理机能的最佳估算。方程的参数因受试者而异。这一整套生理上可行的所有参数集说明了模拟群体的情况。2008年1月,美国食品药品监督管理局(FDA)做出了前所未有的决定,同意将我们的模拟器作为人工胰腺控制器临床前动物试验的替代品。FDA表示,此类计算机模拟足以获得住院患者人体试验的监管批准。突然之间,快速且经济高效的算法开发成为了可能。仅仅3个月后,也就是2008年4月,我们就开始使用我们设计的控制器,并在真实的1型糖尿病患者身上进行了计算机模拟测试。目前,全世界的工程师都在使用弗吉尼亚大学/帕多瓦大学联合研制的模拟器,并且已经放弃了用动物试验来测试新的人工胰腺算法。同时,对人工胰腺其他方面研究的资助也在扩大。2006年,青少年糖尿病研究基金会(JDRF)开始在美国和欧洲的多个中心研发设备;2008年,美国国立卫生研究院启动了一项研究计划;从2010年到2014年,由欧盟资助的AP@Home联盟也很活跃。全球的快速原型设计和测试狂热取得了成果:从2011年9月到2012年1月,以色列、德国和斯洛文尼亚的糖尿病儿童营地开展了第一批门诊研究,利用基于笔记本电脑的人工胰腺系统对1型糖尿病儿童进行了夜间监测。这些早期研究大多认为人工胰腺系统在3个方面优于手动胰岛素治疗。患者的血糖更多时候能控制在目标范围内,减少了低血糖的发生次数,并且更好地控制了睡眠期间的血糖,而监测和管理睡眠过程中的血糖水平是一件很难的事情。不过,这些早期试验都依赖笔记本电脑来运行算法。下一个挑战是实现系统的移动化和无线化,以便能够在真实的生活条件下进行测试。2011年,我们的弗吉尼亚大学团队开发出了第一款移动系统——糖尿病助手。该系统在安卓智能手机上运行,具有图形界面,并且能够通过网络实现远程观察。首先,我们在为期几天到6个月的门诊研究中对它进行了测试。接下来,我们针对因为频繁或严重低血糖发作而处于高风险的患者进行了测试。最后,我们针对患有1型糖尿病并在一个为期5天的滑雪训练营中的儿童身上进行了压力测试。2016年,首个商用混合系统MiniMed 670G的关键试验结束,该系统可全天自动控制胰岛素的持续输注量,但不能控制餐前额外注射的胰岛素剂量。2017年,FDA批准了该系统的临床使用。世界各地的其他研究团队也在测试这类系统,都取得了非常好的结果。2018年对40项研究(共1027名参与者)进行的综合分析发现,与接受标准治疗的患者相比,患者睡眠期间血糖保持在目标范围(70~180 mg/dL)内的时间增加了约15%,总体增加了近10%。我们的第三代机器以Control-IQ技术为基础,由圣地亚哥的坦德姆糖尿病护理公司(Tandem Diabetes Care)制造,在14岁及以上的青少年和成人1型糖尿病患者中进行了为期6个月的随机试验。2019年10月,我们在《新英格兰医学杂志》上发表了研究结果。该系统使用了Dexcom G6连续血糖监测仪(不再需要指尖血糖校准)、Tandem的胰岛素泵,以及最初由弗吉尼亚大学开发的控制算法。该算法直接内置在泵中,因此该系统不需要外部智能手机来处理计算。不过,Control-IQ仍然需要用户一定程度的参与。其混合控制系统要求用户按下按钮表明“我在吃东西”,然后输入预估的碳水化合物量;用户也可以按下按钮表明“我在锻炼”。这些干预虽然不是绝对必要的,但可以帮助将血糖控制得更好。因此,我们可以说,如今的控制器可以达到完全控制,但混合使用会发挥更好的效果。该系统有一个专用的安全模块,当系统预测会出现低血糖时,安全模块会停止或慢慢减少胰岛素的流动。此外,它会在夜间逐渐增加胰岛素剂量,避免早上出现血糖飚升的趋势,并计划在早上7点之前恢复正常血糖水平。这项为期6个月的试验将Control-IQ与标准治疗做了对比测试。在标准治疗中,患者需要利用葡萄糖监测仪提供的信息来操作胰岛素泵,从而完成所有工作。使用Control-IQ的参与者血糖在目标范围内的时间增加了11%,处于低血糖红线(70mg/dL)以下的时间也减少了一半,从2.7%减少至1.4%。2019年12月,FDA批准了对14岁及以上患者临床使用Control-IQ,因此我们的系统成为了第一个“可互操作的自动胰岛素剂量控制器”,它可以连接各种胰岛素泵和连续血糖监测仪。现在,患者还可以定制人造胰腺。从专家在马里兰州会议室表示这个问题无法解决到我们的系统获得FDA批准,经过了近14年。获得批准一个月后,Control-IQ作为在线软件的升级版发布给了Tandem胰岛素泵的用户。2020年6月,在另一项针对6至13岁的1型糖尿病儿童进行的临床试验取得成功后,FDA批准了针对6岁及以上人群使用Control-IQ。与其他年龄组相比,儿童从这项技术中获益最多,因为他们最没有能力管理自己的胰岛素剂量。
2021年4月,我们发表了一份针对已使用Control-IQ一年的9400人的分析报告,这些真实数据证实了早期试验的结果。截至2021年9月1日,已有21个国家的27万多名糖尿病患者在使用Control-IQ。到目前为止,这些患者已经在该系统上登录了3000多万天。一位家长曾向Tandem写信,介绍了Control-IQ在8周内大幅降低了他儿子的平均血糖浓度。“为了这一时刻,我已经等待和辛苦了10年。”他写道,“谢谢你们!”实现更好的自动控制的过程是渐进的;我们希望能够从混合使用平稳过渡到永远不需要患者干预的完全自动化。我们正在研究使用更快发挥作用的胰岛素,目前还处于临床试验阶段。也许有一天我们可以将人工胰腺移植到腹腔,让胰岛素直接进入血液,从而更快地发挥作用。作者:Boris Kovatchev、Anna KovatchevaIEEE Spectrum
《科技纵览》
官方微信公众平台